ALG6 działa jako gen modyfikujący w dziedzicznej genetycznej chorobie oczu barwnikowym zwyrodnieniu siatkówki 59 – Aktualności

Gen modyfikujący to taki, który zmienia obserwowalne cechy, zwane fenotypem lub ekspresją molekularną innych genów.
 Gen modyfikujący to taki, który zmienia obserwowalne cechy, zwane fenotypem lub ekspresją molekularną innych genów.Geny modyfikujące zwiększają złożoność medycyny precyzyjnej. Gen modyfikujący to taki, który ma warianty genetyczne, takie jak zmiany pojedynczego nukleotydu, które różnią się od sekwencji najczęstszej w populacji. Warianty te same w sobie nie powodują choroby, ale w wyniku nieznanych mechanizmów mogą osłabić lub zaostrzyć fenotyp innej choroby genetycznej.
Gen modyfikujący to taki, który zmienia obserwowalne cechy, zwane fenotypem lub ekspresją molekularną innych genów.Geny modyfikujące zwiększają złożoność medycyny precyzyjnej. Gen modyfikujący to taki, który ma warianty genetyczne, takie jak zmiany pojedynczego nukleotydu, które różnią się od sekwencji najczęstszej w populacji. Warianty te same w sobie nie powodują choroby, ale w wyniku nieznanych mechanizmów mogą osłabić lub zaostrzyć fenotyp innej choroby genetycznej.
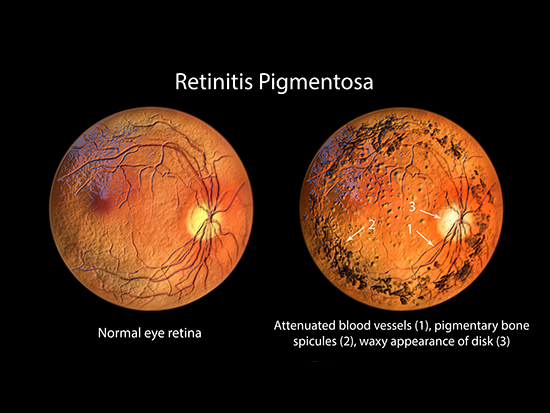
Doktor Steven Pittler z Uniwersytetu Alabama w Birmingham próbował znaleźć geny modyfikujące odpowiedzialne za dziedziczną chorobę oczu, barwnikowe zwyrodnienie siatkówki typu 59. Po wystąpieniu u nastolatków, RP59 powoli powoduje ślepotę przez lata lub dziesięciolecia, atakując siatkówkę z tyłu oka. RP59 jest spowodowane zmianą pojedynczego nukleotydu, która zmienia jeden aminokwas w genie kodującym syntazę difosforanu dehydrodolichylu (DHDDS). DHDDS jest częścią dwupodjednostkowego enzymu wymaganego do glikozylacji białek, czyli kowalencyjnego dodania węglowodanów do białka.
Mutacja DHDDS w RP59 prowadzi do zmiany transmisji synaptycznej i zwyrodnienia siatkówki. Jednakże nie wydaje się, aby choroba ta powodowała problemy w jakimkolwiek innym miejscu organizmu.
N-glikozylacja białek i inne szlaki glikozylacji białek wymagają ponad 35 enzymów. Te modyfikacje białek są kluczowe dla funkcjonowania wszystkich komórek organizmu, w tym rozpoznawania komórek, odpowiedzi immunologicznej, tworzenia macierzy zewnątrzkomórkowej, transportu jonów i substancji rozpuszczonych oraz przekazywania sygnału.
Korzystając z panelu 11 pacjentów z RP59, u których wszyscy mają identyczną, chorobotwórczą mutację punktową w DHDDS, Pittler i współpracownicy zbadali pięć innych genów zaangażowanych w N-glikozylację białek w celu uzyskania dowodów na efekt modyfikujący fenotyp. Spośród pięciu genów tylko jeden, ALG6, wykazywał zmianę w sekwencji genetycznej, która korelowała ze zmienionymi fenotypami wśród pacjentów z RP59. Wariant ALG6 zmienia aminokwas nr 304 w białku ALG6 z fenyloalaniny na serynę.
Pięciu pacjentów z RP59 było heterozygotycznych pod względem wariantu modyfikatora ALG6, co oznacza, że mieli dwa różne allele. Pozostałych sześciu pacjentów wykazywało najczęstszą sekwencję alleli, co oznacza brak zmian w sekwencji DNA w żadnym z alleli ich genów ALG6. Aby wykazać, że wariant ALG6 sam w sobie nie jest patogenny, do badania włączono także trzy osoby z grupy kontrolnej — osoby bez RP59 (bez zmian w stosunku do najczęstszej sekwencji DHDDS). W jednej kontroli brakowało wariantu ALG6 w obu kopiach genu ALG6, natomiast dwie pozostałe były heterozygotyczne i homozygotyczne pod względem wariantu ALG6.
Pittler i współpracownicy z UAB, Uniwersytetu Pensylwanii i Uniwersytetu Stanowego Nowego Jorku w Buffalo zbadali dane zebrane przez pięć dekad dotyczące sześciu parametrów klinicznych dotyczących funkcji i struktury siatkówki u 11 pacjentów z RP59. Raport opublikowany w International Journal of Molecular Sciences pokazuje, że jeden analizowany parametr – utrata wrażliwości pręcików zewnątrzplamkowych – znacząco opóźniał zwyrodnienie pręcików obwodowych w ciągu 30 lat u pacjentów heterozygotycznych pod względem wariantu ALG6. Co więcej, zaobserwowano tendencję w przypadku trzech innych parametrów, które łącznie sugerowały gorszą kondycję fotoreceptorów czopków plamkowych u osób heterozygotycznych pod względem wariantu ALG6.
 Gen modyfikujący to taki, który zmienia obserwowalne cechy, zwane fenotypem lub ekspresją molekularną innych genów.„Ta praca stanowi początek czegoś, co stanie się główną częścią medycyny precyzyjnej, obejmującej szeroką naukę i analizę powiązań genetycznych opartą na sztucznej inteligencji” – powiedział Pittler. „Ogólnie rzecz biorąc, wyniki te wskazują na potencjalny deficyt funkcji czopka plamkowego i jednoczesne zachowanie zdrowia pręcików obwodowych u pacjentów z RP59, u których występuje współekspresja heterozygotycznej mutacji fenyloalaniny-304 do seryny w ALG6”.
Gen modyfikujący to taki, który zmienia obserwowalne cechy, zwane fenotypem lub ekspresją molekularną innych genów.„Ta praca stanowi początek czegoś, co stanie się główną częścią medycyny precyzyjnej, obejmującej szeroką naukę i analizę powiązań genetycznych opartą na sztucznej inteligencji” – powiedział Pittler. „Ogólnie rzecz biorąc, wyniki te wskazują na potencjalny deficyt funkcji czopka plamkowego i jednoczesne zachowanie zdrowia pręcików obwodowych u pacjentów z RP59, u których występuje współekspresja heterozygotycznej mutacji fenyloalaniny-304 do seryny w ALG6”.
„Zatem polimorfizmy genów modyfikujących mogą odpowiadać za znaczną część zmienności fenotypowej obserwowanej w chorobach genetycznych człowieka. Jednak w tym przypadku konsekwencje polimorfizmów są wbrew intuicji złożone, jeśli chodzi o populacje pręcików i czopków dotkniętych różnymi obszarami siatkówki.
W siatkówce ssaków pręciki i czopki to dwa typy komórek fotoreceptorów. Czopki zapewniają widzenie kolorów i gromadzą się głównie w małym, centralnym obszarze dołka i plamki siatkówki, co umożliwia ostre i szczegółowe widzenie w jasnym świetle. Pręciki działają przy niższych poziomach światła, ułatwiając widzenie przy słabym świetle, w którym pośredniczą bardziej peryferyjne obszary siatkówki poza plamką.
Pierwszą autorką badania „Dziedziczone zwyrodnienie siatkówki spowodowane mutacją syntazy difosforanu dehydrodolichylu – wpływ wariantu modyfikatora ALG6” jest Elisha Monson, absolwentka programu UAB Chemistry, obecnie studiująca na wydziale medycznym na Uniwersytecie Iowa. „Przeprowadzenie tego projektu od pomysłu do rezultatu zapewniło doskonałą podstawę w nowoczesnych badaniach i wyjątkowe spojrzenie w przyszłość medycyny precyzyjnej. Jestem szczególnie wdzięczny dr Pittlerowi i moim licznym mentorom na Wydziale Chemii UAB za ich hojne wsparcie.”
Współautorami wraz z Pittlerem i Monsonem są Artur V. Cideciyan, Alejandro J. Roman, Alexander Sumaroka, Malgorzata Swider, Vivian Wu, Iryna Viarbitskaya i Samuel G. Jacobson, Centrum Dziedzicznych Zwyrodnień Siatkówki, Uniwersytet Pensylwanii, Filadelfia; oraz Steven J. Fliesler z Uniwersytetu Stanowego Nowego Jorku w Buffalo.
Wsparcie pochodziło z grantów Narodowego Instytutu Zdrowia EY029341 i EY003039-43.
Pittler jest profesorem w Katedrze Optometrii i Nauk o Wzroku w Szkole Optometrii UAB oraz kieruje Centrum Badawczym Nauk o Wzroku w ramach Szkoły Optometrii. Doktor Paul Gamlin, profesor na Wydziale Okulistyki i Nauk Wizualnych w Marnix E. Heersink School of Medicine, jest zastępcą dyrektora VSRC.
Chemia jest wydziałem w UAB College of Arts and Sciences.






