Badania odkrywają mutację pojedynczego genu, która może powodować toczeń
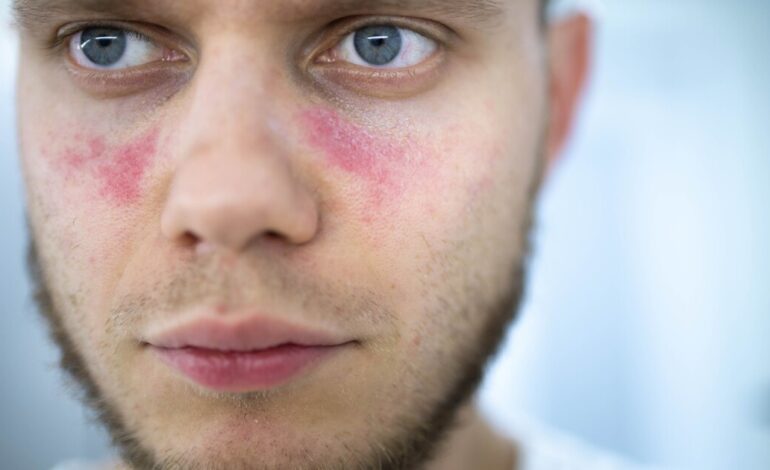
W dwóch oddzielnych badaniach niemieccy badacze zidentyfikowali mutację pojedynczego genu, która może prowadzić do nieuleczalnej choroby autoimmunologicznej tocznia. Odkrycie otwiera drzwi do opracowania nowych podejść terapeutycznych i testowania mutacji, co zapewni wczesne rozpoznanie choroby.
Toczeń powoduje, że układ odpornościowy atakuje tkanki i narządy organizmu, powodując zapalenie nerek, mózgu i centralnego układu nerwowego, naczyń krwionośnych, płuc i serca. Skuteczne leczenie polega na jak najwcześniejszym rozpoznaniu choroby, aby można było opanować stan zapalny, zanim spowoduje trwałe uszkodzenie narządów.
Toczeń jest dziedziczny i wiadomo, że sprzyja mu kilka genów; kobiety są znacznie bardziej narażone na tę chorobę niż mężczyźni. Naukowcy z Instytutu Biologii Zakażeń im. Maxa Plancka w Niemczech zbadali genetykę leżącą u podstaw tocznia i odkryli mechanizm, który może wywołać chorobę.
Wrodzony układ odpornościowy bardzo szybko reaguje na atakujące patogeny, ale należy tę szybką reakcję kontrolować, aby zapobiec zwróceniu się przeciwko organizmowi. Naukowcy badali te mechanizmy kontrolne, koncentrując się na receptorze zwanym receptorem Toll-podobnym 7 (TLR7), o którym wiadomo, że w przypadku nadaktywności powoduje chorobę autoimmunologiczną u myszy.
TLR7 rozpoznaje materiał genetyczny wirusów i bakterii i wyzwala odpowiedź immunologiczną. Aby zapewnić szybką reakcję, w komórkach odpornościowych musi znajdować się pewna liczba TLR7, które utrzymują równowagę poprzez ciągłe wytwarzanie, a następnie degradację receptorów.
„Chcieliśmy zrozumieć, co się dzieje, gdy ta równowaga zostaje zakłócona” – powiedziała Olivia Majer, jedna z autorek badania.
W swojej pracy nad TLR7 naukowcy wykazali, że do degradacji TLR7 w komórkach odpornościowych niezbędny jest kompleks białkowy zwany BORC. Ponadto BORC wymaga innego białka, UNC93B1, aby prawidłowo przeprowadzić proces degradacji. Jeśli w procesie wystąpi błąd, TLR7 nie ulega degradacji i gromadzi się w komórkach.
„Z wcześniejszych eksperymentów na myszach przeprowadzonych kilka lat temu na Uniwersytecie w Berkeley w Kalifornii wiedzieliśmy już, że zbyt wiele z tych receptorów stanowi problem” – powiedział Majer.
Zbyt wiele receptorów popycha układ odpornościowy w stronę odpowiedzi autoimmunologicznej, takiej jak ta obserwowana w toczniu. Przed obecnym badaniem nie łączono ani BORC, ani UNC93B1 z tą chorobą.
Sprawy połączyły się, gdy współautor badania, Fabian Hauck, specjalista wrodzonych zaburzeń odporności w szpitalu uniwersyteckim Ludwiga Maximiliana w Monachium, potwierdził istnienie mutacji UNC93B1 u swojego pacjenta z toczniem o początku w dzieciństwie. Po zbadaniu pacjenta odkryli, że mutacja pojedynczego genu powoduje zmniejszoną interakcję BORC i akumulację TLR7.
Wraz z badaniem Maxa Plancka opublikowanym w czasopiśmie Nauka Immunologia było odrębnym badaniem przeprowadzonym przez naukowców z Politechniki Drezdeńskiej (TU Dresden), również w Niemczech, w którym również badano mutacje genu UNC93B1 i ich związek z toczniem.
Naukowcy przebadali czterech pacjentów z dwóch rodzin, u których wystąpiły objawy tocznia rumieniowatego układowego (SLE), najczęstszego rodzaju tocznia. Ponieważ SLE występuje rzadko u bardzo małych dzieci, badacze zaczęli szukać przyczyny genetycznej i odkryli mutację UNC93B1 u wszystkich członków rodziny.
Podobnie jak w badaniu Majera i Haucka, naukowcy odkryli, że mutacje UNC93B1 prowadzą do selektywnej nadmiernej aktywacji TLR7, co skutkuje atakiem autoimmunologicznym, a następnie stanem zapalnym. Co więcej, odkryli, że stymuluje to przeżycie samoreaktywnych komórek B, które wytwarzają autoprzeciwciała skierowane przeciwko własnym komórkom organizmu i napędzają atak autoimmunologiczny. Na tej podstawie doszli do wniosku, że UNC93B1 kontroluje aktywność receptorów takich jak TLR7, aby zapobiegać chorobom autoimmunologicznym.
„Nasze badanie pokazuje bezpośredni związek przyczynowy między nadaktywnością osi UNC93B1/TLR7 a patogenezą tocznia i wskazuje, że blokowanie nadaktywności TLR7 może być skuteczne terapeutycznie” – stwierdziła Min Ae Lee-Kirsch, korespondentka autorka badania. „W związku z tym oczekuje się, że nasze odkrycia przyspieszą dalszy rozwój inhibitorów TLR7 dla pacjentów ze SLE i pokrewnymi chorobami autoimmunologicznymi”.
Podsumowując, oba badania otwierają drzwi do nowych podejść terapeutycznych, które mogłyby potencjalnie zapobiec rozwojowi szkodliwego stanu zapalnego, który charakteryzuje tę chorobę. Dodatkowo badanie pod kątem mutacji UNC93B1 może stać się częścią leczenia tocznia, zapewniając wczesną diagnozę choroby.
Obydwa badania zostały opublikowane w czasopiśmie Nauka Immunologia. Dostęp do badania Instytutu Maxa Plancka można uzyskać tutaj; studium TU Dresden tutaj.
Źródła: Towarzystwo Maxa Plancka, TU Dresden






