Badanie zmian hematologicznych i genetyki powiązanych z SNV rs10974944 w nowotworach mieloproliferacyjnych wśród pacjentów z Amazonii
Nowotwory mieloproliferacyjne charakteryzują się charakterystycznymi zmianami w badaniach laboratoryjnych, a także wynikami genetycznymi, które pozwalają na ich identyfikację i różnicowanie. Odkrycia dotyczące zmian genetycznych w intronach nie są jeszcze w pełni poznane, ale scenariusz ten cieszy się coraz większym zainteresowaniem w kontekście zrozumienia aspektów etiopatogenetycznych i roli tych regionów DNA w tych chorobach.
Nadpłytkowość samoistna okazała się najczęstszym nowotworem mieloproliferacyjnym, co jest zbieżne z założeniami Torresa15który badał populację BCR::ABL1-ujemne nowotwory mieloproliferacyjne w stanie Amazonas (Brazylia). Podobne dane opisał Macedo16którzy opisali podobny scenariusz u pacjentów ze stanów Paraná i São Paulo, którzy mieli ten sam nowotwór hematologiczny, a dane te są zbieżne z opisami znalezionymi w innych krajach17,18.
Rozpiętość wiekowa badanych mieściła się w przedziale od piątej do siódmej dekady życia, co jest zgodne z ustaleniami innych badań19,20. Postępująca akumulacja zmian genetycznych w hematopoetycznych komórkach macierzystych i biologicznej maszynerii systemu naprawy DNA21,22wzrost lub spadek telomerów23,24 oraz skumulowane narażenie na czynniki ryzyka przez całe życie, takie jak palenie i otyłość25,26może wyjaśniać częstość występowania tej grupy wiekowej w kontekście nowotworów mieloproliferacyjnych.
Jeśli chodzi o charakterystykę kliniczną, czerwienica prawdziwa (PV) wykazała równy odsetek mężczyzn i kobiet, podczas gdy nadpłytkowość samoistna (ET) ujawniła większość przypadków z udziałem kobiet, a dane te są zgodne z literaturą27,28. Niektóre badania wykazały, że u kobiet ryzyko rozwoju nowotworów mieloproliferacyjnych jest zwiększone29 oraz większe prawdopodobieństwo wystąpienia powikłań sercowo-naczyniowych i splenomegalii26. Przyczyna tego ryzyka jest niepewna, ale możliwymi czynnikami przyczyniającymi się do tego procesu mogą być zmiany w chromosomach płciowych, czynnikach hormonalnych i ekspresji genów28. Dane laboratoryjne oraz zdarzenia zakrzepowe i krwotoczne przedstawione zgodnie z oczekiwaniami dla każdego nowotworu: PV wykazało większą częstość występowania podwyższonych wartości erytrogramu, a ET wykazało zmiany w szeregu megakariocytów, z większym ryzykiem zdarzeń krwotocznych, zgodnie z opisem Światowej Organizacji Zdrowia3oraz w innych badaniach na ten temat27,30.
Jeśli chodzi o wyniki badań genetycznych, PV wykazuje większą częstość występowania pozytywnych przypadków wirusa JAK2 V617F wariant, ponieważ jest on bezpośrednio związany ze specyficzną patogenezą tego nowotworu hematologicznego36 i odgrywa rolę w konstytutywnej aktywacji szlaku JAK-STAT5. Warto zauważyć, że 58% naszej populacji fotowoltaicznej miało pozytywny wynik dla tego wariantu, co może początkowo różnić się od wyników powszechnie opisywanych w literaturze, które wskazują na JAK2 V617F częstotliwości ponad 70% u pacjentów z Brazylii, Korei, Chin, Japonii i Europy31,32,33,34,35.
Nasza analiza ujawnia zauważalną specyficzność w naszej populacji w porównaniu z danymi udokumentowanymi w literaturze, zwłaszcza u pacjentów z PV, gdzie 42% tych pacjentów nie prezentowało JAK2 V617F wariant lub inne patogenne zmiany genetyczne wzdłuż regionu kodującego JAK2zgodnie z kryteriami diagnostycznymi WHO3. To nietypowe zachowanie sugeruje znaczne luki w naszej wiedzy na temat czynników genetycznych leżących u podstaw etiopatogenezy nowotworów mieloproliferacyjnych w populacji amazońskiej. Ta luka podkreśla pilną potrzebę dalszych badań w celu uzyskania pełniejszego zrozumienia profilu genetycznego tych chorób i innych czynników. Dlatego zalecane są dodatkowe badania w naszej populacji, badające inne geny istotne dla mielopoezy i regulacji epigenetycznej, takie jak DNMT3A (Metylotransferaza DNA 3 alfa), NFE2 (Czynnik jądrowy erytroid 2), SF3B1 (Współczynnik splicingu 3b Podjednostka 1), TET2 (Tet Dioksygenaza metylocytozynowa 2), ASXL1 (Regulator transkrypcji ASXL 1) i EZH2 (Wzmacniacz podjednostki kompleksu represyjnego Zeste 2 Polycomb 2)21,52. Analiza tych genów może dostarczyć cennych informacji na temat zachowania genetycznego nowotworów mieloproliferacyjnych w populacji amazońskiej i wyjaśnić inne czynniki związane z patofizjologią PV, poza znanymi wariantami JAK2 V617F I JAK2 eksony 12 i 14.
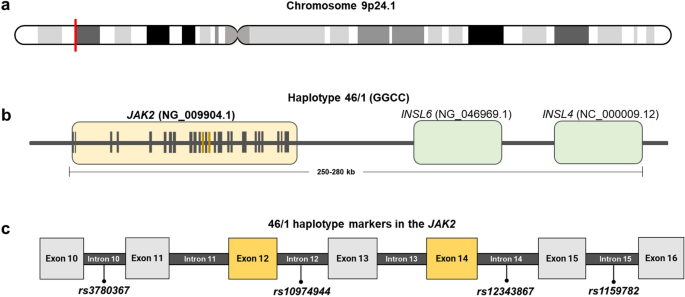
W literaturze haplotyp linii zarodkowej 46/1, identyfikowany przez rs10974944 (C > G), ma dobrze udokumentowane powiązanie z JAK2 V617F14,36,37,38 co również zaobserwowano w naszym badaniu. Dane dotyczące częstości występowania allelu mniejszego rs10974944 w populacji Brazylii i regionie Amazonii pozostaje niewielka, co czyni to badanie pionierskim w tym badaniu. Brak wcześniejszych badań nad tym wariantem w populacji amazońskiej podkreśla znaczenie obecnych prac nad wypełnieniem tej luki w wiedzy genetycznej tej populacji. Jednak częstotliwość haplotypu 46/1, związana z rs10974944powiązano z większą częstością występowania u pacjentów z nowotworami mieloproliferacyjnymi, zwłaszcza u pacjentów z nowotworami mieloproliferacyjnymi JAK2 V617F+. Zależność tę zaobserwowano nie tylko w innych populacjach brazylijskich, jak opisali Macedo i in.16 ale także w badaniach przeprowadzonych na różnych populacjach na całym świecie, w tym na populacjach azjatyckich, europejskich i północnoamerykańskich, jak omówiono w jednym z naszych poprzednich przeglądów integracyjnych13. Ponadto wkład przodków w populację Brazylii, szczególnie w regionie Amazonii, charakteryzuje się mieszanką trzech głównych grup etnicznych: rdzennych Amerykanów (NAM), Europejczyków (EUR) i Afrykanów (AFR)39. Dlatego prawdopodobne jest wywnioskowanie, że zachowanie genetyczne wariantu w tych populacjach, jak opisano wcześniej, jest podobne, co wzmacnia dyskusję dotyczącą podobnego zachowania w naszej populacji.
Wysoka częstotliwość allelu G rs10974944 u osób pozytywnie nastawionych JAK2 V617F wnosi wkład w dyskusje na temat nielosowej korelacji między tymi dwiema zmianami genetycznymi13,40 Zależność ta jest zgodna z innym wnioskiem z naszego badania, haplotypem 2 (rs10974944G/rs10815151C/rs1011004A/rs77375493T), co wzmacnia koncepcje oparte na interakcji pomiędzy rs10974944 (C > G) i JAK2 V617F (rs77375493—G > T). Propozycje te są zgodne z ustaleniami dotyczącymi haplotypu 46/1 w innych populacjach Brazylii, Tajwanu, Europy, Chin i Japonii16,32,33,34,41wskazując, że możliwe mechanizmy poprzedzające przejęcie JAK2 V617F nie są ograniczone do określonej grupy etnicznej; dlatego też jego ewolucyjne podłoże można uznać za genetyczny czynnik predyspozycji do choroby8.
Badania wskazują na większe ryzyko u osób z genotypem GG rs10974944 być pozytywnym dla JAK2 V617F14,40,42. Zgodnie z wynikami powyższych badań, w naszej populacji ryzyko zakażenia pozytywnego wzrastało czterokrotnie JAK2 V617F u osób z genotypem GG rs10974944 (OR 4,1; 95% CI 8–13,9). Odkrycia te potwierdzają hipotezę hipermutowalności, która ustanawia haplotyp 46/1 jako czynnik rozregulowujący JAK2 genu, co zwiększa ryzyko błędów replikacji DNA i warunkuje mutagenny scenariusz nabywania wariantów o selektywnych zaletach, takich jak JAK2 V617F43,44,45.
Stowarzyszenie rs10974944 (G) i JAK2 V617F VAF sugeruje możliwy udział haplotypu 46/1 w ekspansji klonalnej. Zidentyfikowaliśmy sześciokrotnie wyższe ryzyko u osób będących nosicielami allelu G rs10974944 I JAK2 V617F VAF ≥ 50%. Nasze dane wskazują, że marker haplotypu 46/1 może odgrywać rolę nie tylko w nabywaniu JAK2 V617F ale przypisuje się go również ekspansji klonalnej, utrzymaniu i przetrwaniu. Tefferi46 sugeruje, że JAK2 V617F nie jest początkowym zdarzeniem klonogennym w MPN, ale raczej jednym z kilku subklonów pochodzących z klonu przodka. Jest to zgodne z notatkami Pardanani i in.47co potwierdza hipotezę, że haplotyp ten zlokalizowany jest w korzystnym środowisku regulacyjnym cis, co ułatwia nabywanie JAK2 V617Fa który z kolei jest odpowiedzialny za ekspansję klonalną i rozwój MPN.
Co więcej, możliwa rola nabytej disomii jednorodzicielskiej, zdarzenia genetycznego prowadzącego do rekombinacji mitotycznej związanej z neutralną utratą heterozygotyczności chromosomu 9p u pacjentów z MPN, zmniejszając zarówno haplotyp, jak i JAK2 V617F do stanu homozygotycznego14,48,49, Nie można wykluczyć. W tym kontekście komórki z obydwoma wariantami teoretycznie mają selektywną przewagę, która warunkuje większy potencjał mieloproliferacyjny i sprzyja tworzeniu się komórek wariantowych w stosunku do komórek zdrowych, co wyjaśnia zwiększony VAF u osób stosujących kombinację rs10974944 (G) +rs77375493 (T) ( JAK2 V617F) w homozygotyczności.
W literaturze obserwuje się związek pomiędzy zmianami wskaźników hematologicznych, charakterystyką kliniczną a obecnością 46/116,33,50; nie jest to jednak konsensus wśród społeczności naukowej8. Nasze dane pokazują istotne różnice w wartościach MCV, MCH w grupie PV oraz RBC, Hb i Ht u nosicieli TE allelu G rs10974944co zaobserwowano w poprzednich badaniach7,42,51. Znacząca demonstracja rs10974944 ze zdarzeniami zakrzepowymi wzmacnia zastosowanie tego wariantu jako narzędzia do monitorowania pacjentów i badania wyników klinicznych czerwienicy prawdziwej. Aby uzyskać bardziej wiarygodną korelację tej korelacji, potrzebne są nowe badania z bardziej solidnymi populacjami, aby obserwować zachowanie wariantu w odniesieniu do cech klinicznych i hematologicznych u pacjentów z PV.
Niniejsze badanie jest pierwszym, w którym analizowano haplotyp 46/1 za pomocą rs10974944 wariant, obecny w intronie 12 JAK2w populacji brazylijskiej Amazonii. Wyniki tego badania pokazują, że wariant rs10974944 (G) ma silną korelację z JAK2 V617F+ wariant, zademonstrowany zwłaszcza w PV_JAK2 V617F+ pacjenci. Korelacja wariantu z wysokim obciążeniem wariantem allelicznymJAK2 V617Fobserwowano także zdarzenia zakrzepowe i zmiany hematologiczne. Wariant ten stanowi obiecującą możliwość zastosowania klinicznego do badania i monitorowania zmian laboratoryjnych i/lub zwiększonego VAF w zidentyfikowanych nowotworach hematologicznych.