Jak geny i epigenetyka kształtują fałdowanie mózgu
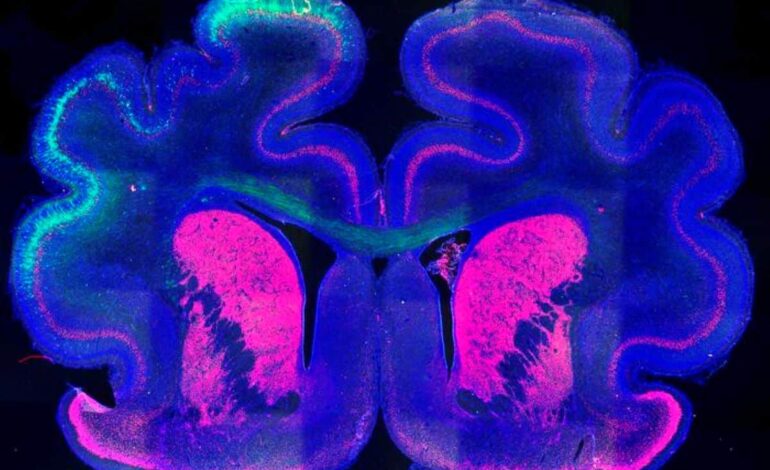
Streszczenie: Nowe badanie ujawniło, jak znaki epigenetyczne i białko Cux2 wpływają na fałdowanie mózgu. Badanie pokazuje, że znaczniki epigenetyczne H3K27ac i Cux2 są kluczem do tworzenia zakrętów i bruzd kory mózgowej.
Odkrycia te pogłębiają naszą wiedzę na temat rozwoju mózgu i mogą pomóc w leczeniu wad rozwojowych mózgu. Badania podkreślają złożoność układu nerwowego i kluczową rolę epigenetyki w strukturze mózgu.
Kluczowe fakty:
- Znak epigenetyczny H3K27ac i białko Cux2 są kluczowe dla fałdowania mózgu.
- Cux2 może zmieniać wzorce fałdowania mózgu, nawet u zwierząt o gładkich mózgach.
- Odkrycia dają wgląd w leczenie wad rozwojowych mózgu związanych z defektami fałdowania.
Źródło: Uff
Określenie czynników genetycznych i epigenetycznych wpływających na fałdowanie mózgu jest celem najnowszego badania, którego współpracownikiem jest laboratorium Neurogenezy i Ekspansji Korowej, kierowane przez badacza Víctora Borrella z Instytutu Neuronauk (IN), wspólnego ośrodka hiszpańskiego Krajowego Instytutu Badawczego Council i Uniwersytetu Miguela Hernándeza (UMH) w Elche oraz laboratorium kierowane przez badaczkę Vijay K. Tiwari w Instytucie Medycyny Eksperymentalnej Wellcome-Wolfson na Queen’s University w Belfaście (Wielka Brytania).
Praca ta została opublikowana w czasopiśmie Postęp naukiwykazało, że znaki epigenetyczne są kluczowym mechanizmem w instrukcjach, które powodują powstawanie fałdów kory mózgowej i że białko Cux2 odgrywa decydującą rolę w tym procesie.
Zespół Borrella opracował już protomapę, która pozwala ustalić na poziomie genetycznym, gdzie w mózgu powstaną zakręty i bruzdy na etapie rozwoju embrionalnego, na którym jeszcze nie zaczęły się tworzyć fałdy.
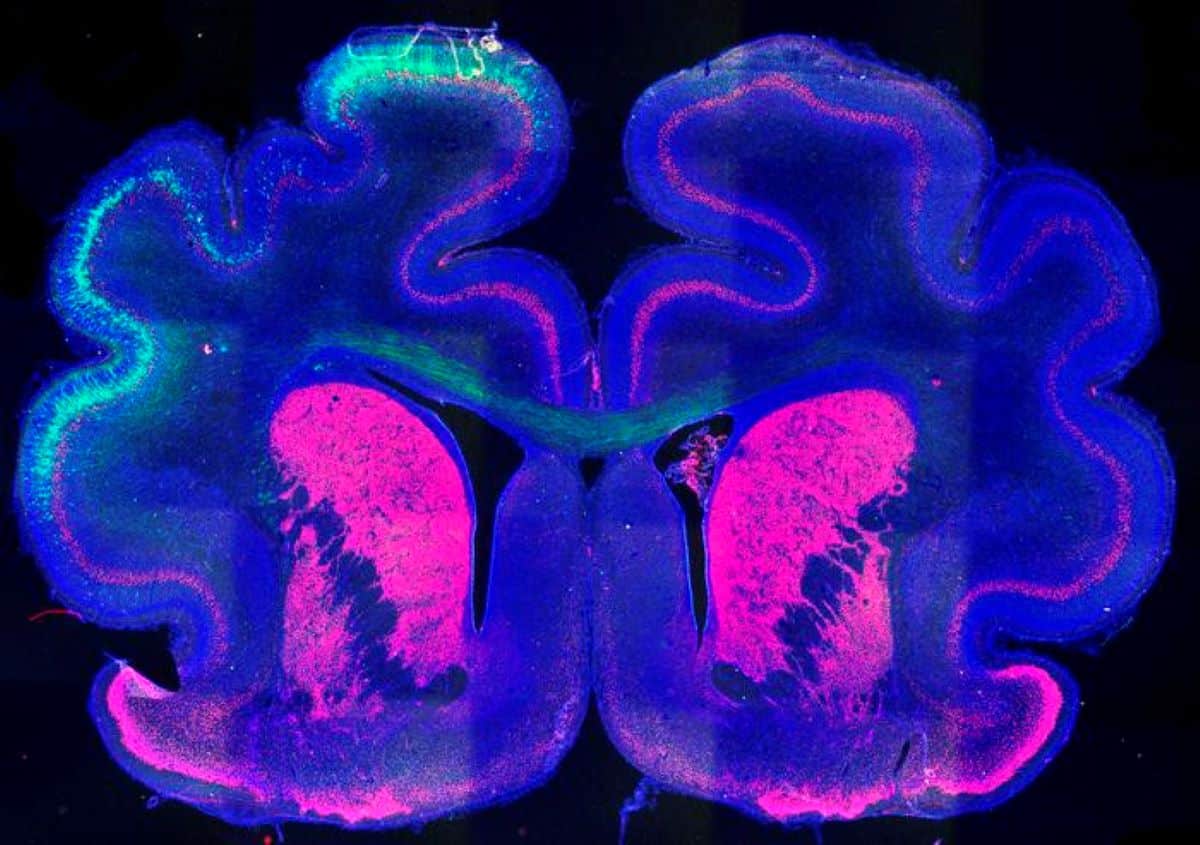
„Na początku kora jest gładka, ale jest tam obszar, który bardzo się powiększy, a w miarę wzrostu wytworzy się zakręt. Tymczasem obok niego inne obszary będą rosły mniej i pozostaną zapadnięte, tworząc bruzdę” – wyjaśnia badaczka i dodaje: „Dzieje się tak, ponieważ w korze zarodka znajdują się tysiące genów, które ulegają ekspresji w czasie jego rozwoju. Nie są one jednak wyrażone w jednakowej wysokości we wszystkich obszarach”.
Dzięki współpracy z laboratorium Tiwari, ekspertem w dziedzinie epigenetyki i analizy epigenomicznej, udało im się posunąć badania o krok dalej i zbadać tak zwany krajobraz epigenetyczny komórek kory mózgowej:
„Badaliśmy znacznie więcej niż tylko konkretny gen w określonej lokalizacji, ale byliśmy w stanie obserwować całe DNA z komórek i jego modyfikacje epigenetyczne, które determinują zachowanie tych genów, aby zrozumieć mechanizmy, które powodują powstanie genu ekspresję tych genów” – podkreśla Borrell.
Aby opracować to badanie, naukowcy skupili się na znaku epigenetycznym H3K27ac, ponieważ jest to wskaźnik o największej zdolności przewidywania ekspresji genów.
Wyniki były jednak zaskakujące: „Zaobserwowaliśmy, że w wielu miejscach, w których występował H3K27ac, nie wystąpiła ekspresja genów, ale zaobserwowaliśmy także odwrotny przypadek, w przypadku których geny ulegały ekspresji bez obecności znaku epigenetycznego” – mówi Lucía del Valle Antón, współpierwszy autor artykułu.
Eksperci są zgodni, że to odkrycie jest wyraźnym wskaźnikiem złożoności układu nerwowego: „W dziedzinie epigenetyki znajdujemy dowody sugerujące, że układ nerwowy w trakcie swojego rozwoju stanowi wyjątek i nie funkcjonuje w taki sam sposób jak reszta tkanek ciała. Bez wątpienia przed nami długa droga do nauki i jest to ekscytujące wyzwanie” – podkreśla Borrell.
To nieoczekiwane odkrycie skłoniło ich do zbadania, co dzieje się w genach, w których występuje zbieżność między znakiem H3K27ac a ekspresją. Aby tego dokonać, skupili się na białkach, które bezpośrednio regulują intensywność ekspresji genów: czynnikach transkrypcyjnych. Konkretnie białko Cux2, gdyż jego udział w rozwoju mózgu jest powszechnie znany.
Cux2, główny czynnik
Cux2 jest białkiem biorącym udział w różnicowaniu neuronów, wzroście dendrytów i ogólnie w tworzeniu obwodów neuronalnych. Eksperci chcieli sprawdzić wpływ tego czynnika na zwijanie mózgu i w tym celu wprowadzili DNA kodujący to białko do mózgu zarodka w czasie jego ciąży.
Dzięki tej technice potwierdzili, że Cux2 jest w stanie zmieniać wzorce fałdowania: „Może generować fałdy w korze mózgowej myszy, która poza tym jest gładka, a w przypadku fretki, która ma już fałdy, białko może całkowicie zmienić ustalony wzór składania” – wyjaśnia del Valle Antón.
Wyniki te ujawniają kluczową rolę Cux2 w fałdowaniu: „Wiemy, że aby powstały fałdy, musi nastąpić wiele procesów, a po przeprowadzeniu tego badania ustaliliśmy, że Cux2 jest głównym czynnikiem, który może wykorzystać krajobraz epigenetyczny dokonać zmian prowadzących do ekspresji tysięcy genów realizujących różne zadania. Połączenie tego wszystkiego umożliwia tworzenie fałd” – wyjaśnia Borrell.
Dzięki sekwencjonowaniu pojedynczych komórek naukowcy mogli przeanalizować zmiany, jakie Cux2 powoduje w komórkach, tworząc zakręt. Potwierdzili, że istnieje rodzaj radialnych komórek glejowych, czyli komórek macierzystych odpowiedzialnych za wytwarzanie neuronów, który praktycznie zanika, umożliwiając proliferację innych typów promieniowych komórek glejowych w większych ilościach.
Wpływa to nie tylko na rodzaj progenitora, z którego powstają neurony, ale także na linię komórkową, za którą podążają, co z kolei jest bezpośrednio zaangażowane w rozwój zakrętów i bruzd w mózgu.
Składanie jest cechą ludzkiego mózgu, która, jeśli jest wadliwa, prowadzi do poważnych niepełnosprawności w uczeniu się i intelektualnej. Czasami u pacjentów występują mutacje genetyczne, które powodują wady rozwojowe mózgu z powodu braku zakrętów. W tym względzie Borrell wskazuje, że prowadzenie badań podstawowych „jest niezbędne do zrozumienia biologii tych chorób i pozwala nam być nieco bliżej znalezienia możliwych rozwiązań”.
Finansowanie: Praca ta była możliwa dzięki finansowaniu przez Europejską Radę ds. Badań Naukowych (ERC) w ramach programu Unii Europejskiej „Horyzont Europa”, Hiszpańską Państwową Agencję ds. Badań – Hiszpańskie Ministerstwo Nauki, Innowacji i Uniwersytetów poprzez programy projektowe Generación de conocimiento, FPI i Juan de la Cierva, Program „Severo Ochoa” dla centrów doskonałości w dziedzinie badań i rozwoju, Fundacja „La Caixa”, Niemieckie Towarzystwo Badawcze (Deutsche Forschungsgemeinschaft), Fundacja Novo Nordisk i Duńska Krajowa Fundacja Badań ( DNRF).
Badania te są częścią projektu UNFOLD „Rozwój dynamicznej interakcji między procesami mechanicznymi i molekularnymi w fałdowaniu mózgu” (ERC-2023-SyG nr 101118729), którego celem jest badanie fałdowania korowego z punktu widzenia mechaniki i biologii komórki i genetyka.
O tym aktualności z badań genetyki i epigenetyki
Autor: Angeles Gallara
Źródło: Uff
Kontakt: Angeles Gallar – UMH
Obraz: Autorem obrazu jest Instituto de Neurociencias UMH-CSIC
Orginalne badania: Otwarty dostęp.
„Krajobraz regulacyjny genów fałdowania kory mózgowej” Víctor Borrell i in. Postęp nauki
Abstrakcyjny
Krajobraz regulacyjny genów fałdowania kory mózgowej
Pofałdowanie kory mózgowej jest kluczowym aspektem rozwoju i ewolucji mózgu ssaków, a defekty są powiązane z poważnymi zaburzeniami neurologicznymi.
Pierwotne fałdowanie zachodzi w wysoce stereotypowych wzorach, które są z góry określone w korowych strefach rozrodczych przez protomapę transkryptomiczną. Krajobraz regulacyjny genów rządzący pojawieniem się tej składanej protomapy pozostaje nieznany.
Scharakteryzowaliśmy czasoprzestrzenną dynamikę ekspresji genów i aktywnego krajobrazu epigenetycznego (H3K27ac) w potencjalnych fałdach i szczelinach u fretki.
Nasze wyniki pokazują, że protomapa transkryptomiczna zaczyna pojawiać się na wczesnych etapach embrionalnych i obejmuje szlaki sygnalizacyjne losu komórki. Krajobraz H3K27ac ujawnia ograniczenia w rozwoju komórek i angażuje znane regulatory rozwoju, w tym czynnik transkrypcyjny Cux2.
Manipulowanie Cux2 ekspresja w komórkach progenitorowych kory mózgowej zmieniła ich proliferację i wzór fałdowania u fretek, spowodowane przez selektywne zmiany transkrypcyjne, jak wykazały analizy sekwencjonowania RNA pojedynczych komórek.
Nasze odkrycia podkreślają kluczowe znaczenie mechanizmów epigenetycznych w definiowaniu wzorców fałdowania kory mózgowej.






