Kluczowe wskazówki dotyczące mechanizmu naprawy DNA mogą prowadzić
obraz:
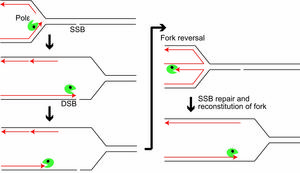
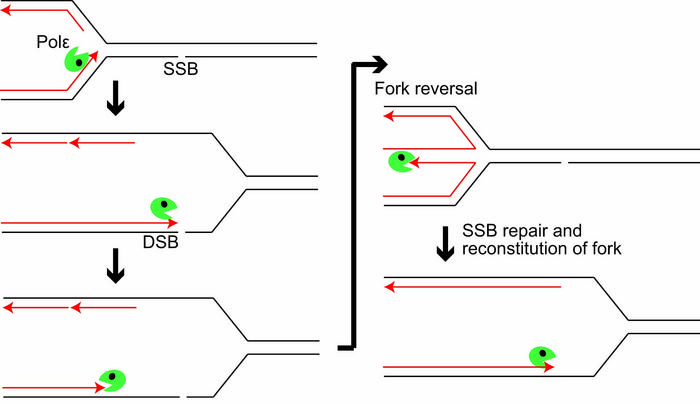
Kiedy pojawia się SSB, polimeraza epsilon zbliża się do nacięcia, a następnie odtwarza swoje kroki dzięki swojej egzonukleazie, umożliwiając odwrócenie widełek. Nick zostanie naprawiony jako SSB i replikacja może być kontynuowana w zwykły sposób.
pogląd więcej
Źródło: Uniwersytet Metropolitalny w Tokio
Tokio, Japonia – Naukowcy z Tokyo Metropolitan University zidentyfikowali kluczowe czynniki w mechanizmie naprawy DNA w naszym organizmie. Po raz pierwszy wykazali, że „korekta” części enzymu replikującego DNA, polimerazy epsilon, zapewnia bezpieczne zakończenie replikacji w uszkodzonych częściach nici DNA, ostatecznie chroniąc DNA przed poważnymi uszkodzeniami. Ta nowa wiedza zapewnia naukowcom sposoby zwiększania skuteczności leków przeciwnowotworowych oraz nowe metody diagnostyczne.
Nasze DNA jest atakowane. Każdego dnia w niciach tworzących helisy DNA w poszczególnych komórkach pojawia się około 55 000 pęknięć pojedynczej nici (SSB). Kiedy polimerazy, cząsteczki replikujące nici DNA, próbują utworzyć nowe helisy z nici z przerwami, mogą rozbić helisę, tworząc tak zwane jednokońcowe pęknięcie dwuniciowe (seDSB). Na szczęście komórki mają własne sposoby radzenia sobie z uszkodzeniami nici. Jednym z nich jest naprawa ukierunkowana na homologię (HDR), w której naprawiane są pęknięcia dwuniciowe. Innym jest „odwrócenie rozwidlenia”, w którym proces replikacji zostaje odwrócony, zapobiegając przede wszystkim przekształceniu nacięć jednoniciowych w DSB.
Dokładny mechanizm odpowiedzialny za odwrócenie widełek pozostaje nieznany. Zrozumienie, w jaki sposób zapobiega się uszkodzeniom DNA, ma ogromne znaczenie nie tylko w celu zapobiegania nowotworom, ale także zapewnienia skuteczności leków przeciwnowotworowych, które opierają się na uszkodzeniu DNA. Weź kamptotecynę (CPT), lek przeciwnowotworowy, który wprowadza wiele przerw w pojedynczej nici; ponieważ komórki nowotworowe mają tendencję do szybszej replikacji, tworzą dużo seDSB i wymierają, pozostawiając normalne komórki w mniejszym stopniu uszkodzone.
Teraz międzynarodowy zespół kierowany przez profesora Kouji Hirata z Tokyo Metropolitan University rzucił nowe światło na działanie odwrócenia widełek. Skupili się na polimerazie epsilon, enzymie odpowiedzialnym za wytwarzanie nowego DNA z części DNA, która uległa rozpakowaniu. Odkryli, że egzonukleaza, „korekcyjna” część polimerazy zapewniająca dokładność kopiowania, odegrała kluczową rolę, co stanowi nowy, rzadki wgląd w w dużej mierze nieznany mechanizm molekularny stojący za odwróceniem widełek.
Po pierwsze, odkryli, że komórki pozbawione części egzonukleazy wykazywały dużą podatność na ekspozycję na CPT. Tłumienie czynnika zwanego PARP, jedynego czynnika wpływającego na odwrócenie widełek, również prowadziło do zwiększonej śmierci komórek. Jednakże, gdy oba zostały stłumione, nie zaobserwowano dalszego wzrostu śmierci komórek poza tym, co zaobserwowano w przypadku PARP. Sugeruje to, że PARP i egzonukleaza polimerazy epsilon współpracują, aby wywołać odwrócenie widełek. Ponadto zespół badał komórki z uszkodzonym genem kodującym BRCA1 (białko podatności na raka piersi); dodatkowy niedobór egzonukleazy spowodował drastycznie zwiększoną wrażliwość na CPT, znacznie większą niż oczekiwano w przypadku którejkolwiek wady. Ponieważ niedobór BRCA1 wiąże się z wysokim ryzykiem raka piersi, egzonukleaza może zostać ukierunkowana na zwiększenie skuteczności leczenia farmakologicznego.
Znaczenie tej pracy jest wielorakie. Wykazali, że leki ukierunkowane na egzonukleazę polimerazy epsilon mogą wzmacniać działanie leków przeciwnowotworowych. Co równie ważne, defekty egzonukleazy zaobserwowano już w przypadku szerokiego zakresu nowotworów, w tym raka jelit; sprawia to, że prawdopodobne jest, że takie komórki mają upośledzoną zdolność odwracania widełek, co jest obiecującym celem przyszłej diagnostyki i leczenia.
Praca ta była wspierana przez Fundację Kanae, Uniwersytet w Shenzhen, Plan Talentów Rzeki Perłowej mający na celu wprowadzenie talentów wysokiego szczebla [2021JC02Y089]Fundacja Naukowa Takeda, grant na zaawansowane badania rządu metropolitalnego Tokio [R3-2], Wspólne Centrum Wykorzystania/Badań typu Sieciowego ds. Medycyny Katastrof Radiacyjnych Uniwersytetu w Hiroszimie, Uniwersytetu Nagasaki, Uniwersytetu Medycznego w Fukushimie, Fundacji Naukowej Yamada; Numery grantów JSPS KAKENHI 16H06306, 16H12595, 20K06760, 22K15040, JP19KK0210, JP20H04337, JP21K19235, Chińska Narodowa Fundacja Nauk Przyrodniczych [32250710138]Fundacja Pamięci Uehara, Advanced Research Networks, krajowy kluczowy program badawczo-rozwojowy [2022YFA1302800]oraz program JSPS Core-to-Core. Fundusze na udostępnienie pracy udostępniono za pośrednictwem numeru grantu badawczego dla zaawansowanych badań rządu metropolitalnego Tokio [R3-2].
Dziennik
Badania kwasów nukleinowych
Tytuł artykułu
Korekcyjna egzonukleaza wiodącej nici polimerazy DNA epsilon zapobiega zapadaniu się widełek replikacyjnych w przypadku zerwanych nici szablonu
Data publikacji artykułu
8 listopada 2023 r
Zastrzeżenie: AAAS i EurekAlert! nie odpowiadają za dokładność komunikatów prasowych publikowanych w EurekAlert! przez instytucje wnoszące wkład lub za wykorzystanie jakichkolwiek informacji za pośrednictwem systemu EurekAlert.






