Komórki odpornościowe noszą długotrwałą „pamięć” bólu we wczesnym okresie życia
Badania na myszach sugerują, że pomocne może być ukierunkowanie na zmiany genetyczne w komórkach makrofagów
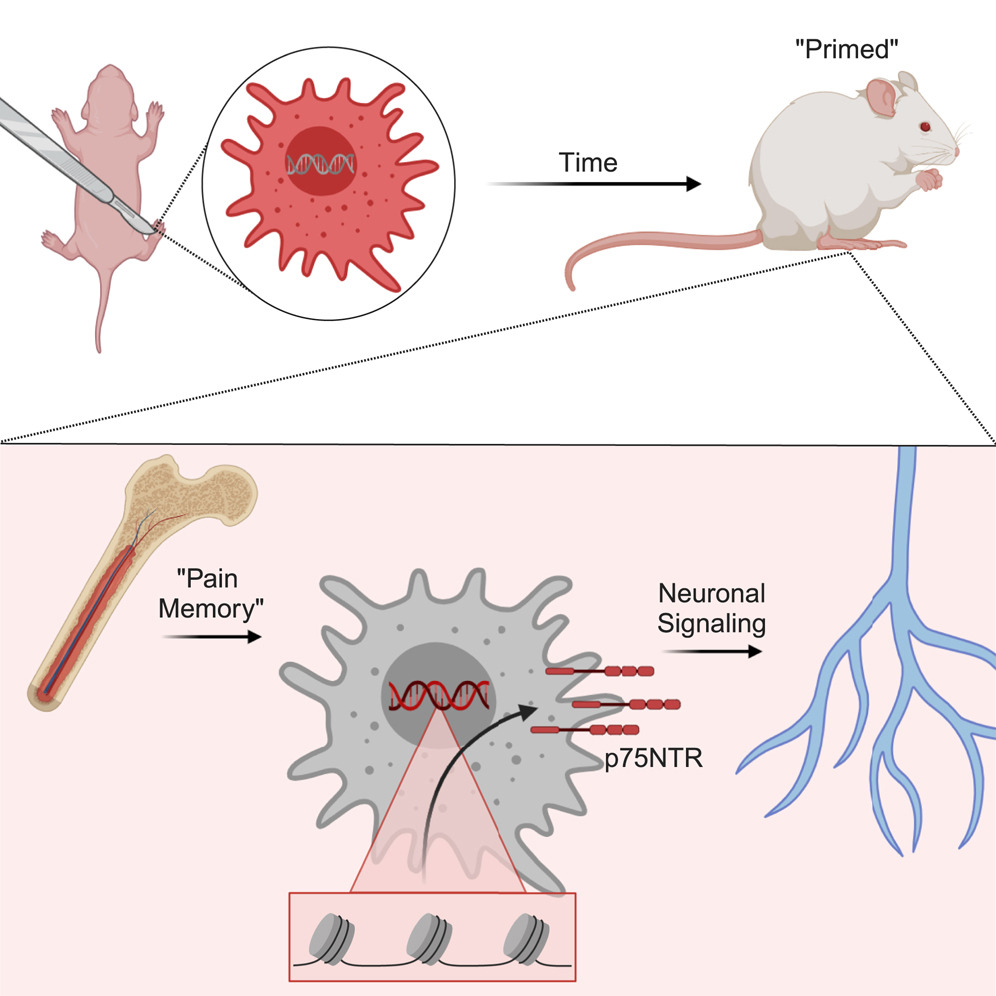
W ostatnich latach coraz większa liczba badań wykazała, że organizm ludzki potrafi „pamiętać” ból związany z urazami noworodków – w tym operacjami ratującymi życie – aż do okresu dojrzewania.
Wydaje się, że te wczesne doświadczenia zmieniają sposób, w jaki dziecko reaguje na ból na poziomie genetycznym, co skutkuje bardziej intensywnymi reakcjami na ból w późniejszym życiu. Wydaje się, że takie zmiany częściej występują także u kobiet.
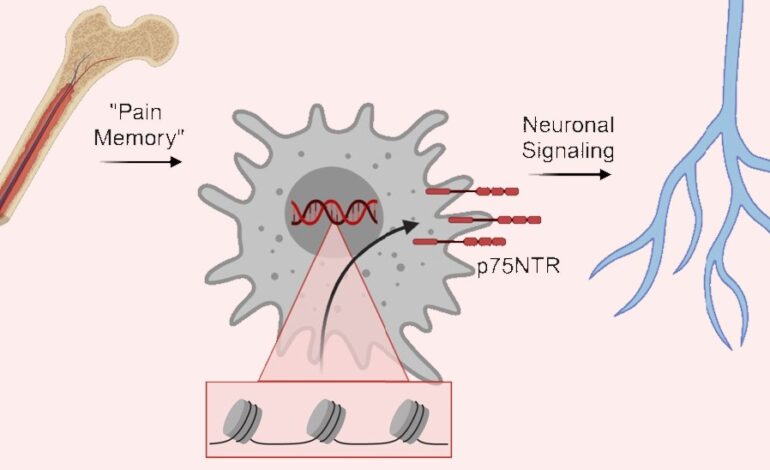
Teraz badania prowadzone przez ekspertów z Cincinnati Children’s wskazują, jak i gdzie zachodzą zmiany genetyczne, które powodują tak długotrwałą pamięć bólu. Jak wynika z ich badania, opublikowanego online 18 kwietnia 2024 r. w czasopiśmie Raporty komórkowekluczowe zmiany zachodzą w rozwoju komórek makrofagów – jednego z głównych elementów układu odpornościowego.
„Nasze eksperymenty pomagają jeszcze bardziej potwierdzić, jak wspomnienia bólu wpływają na noworodki płci żeńskiej przez dłuższy czas. W szczególności nasze dane wskazują, że zmiany epigenetyczne (zmiany zachodzące po urodzeniu w porównaniu z odziedziczonymi zmianami genów) zachodzą w makrofagach po urazie we wczesnym okresie życia, co z kolei sprzyja intensywniejszym reakcjom bólowym na inne urazy, które mają miejsce w późniejszym życiu”. mówi autor korespondenta dr Michael Jankowski, zastępca dyrektora Centrum Badań nad Bólem Dziecięcym w Cincinnati Children’s.
Głównym autorem badania był doktor Adam Dourson, obecnie pracujący na Uniwersytecie Waszyngtońskim w St. Louis.
Eksperymenty pokazują, że samce myszy doświadczające podobnych urazów na początku życia wykazują te same zmiany epigenetyczne, ale nie zachowują tej samej długoterminowej pamięci bólu co samice. Dalsze badania wykazały również, że zmiany zachodzące w genie tzw p75NTRmożna znaleźć w ludzkich komórkach makrofagów.
U samic myszy skutki pamięci bólu wykrywano przez ponad 100 dni po początkowym urazie. Nacięcia spowodowały, że komórki macierzyste w szpiku kostnym wytworzyły makrofagi, które zostały „przygotowane” do intensywniejszej reakcji na urazy, co z kolei zwiększa ból.
U ludzi podobny okres wynosiłby około 10–15 lat.
„Zaskoczyło nas, jak pojedyncza, lokalna infekcja tak radykalnie zmieniła krajobraz epigenetyczny/transkryptomiczny makrofagów” – mówi Jankowski.
To nowe zrozumienie pamięci bólu u noworodków podkreśla fundamentalne różnice istniejące między aktywnością genetyczną wciąż rozwijającego się układu odpornościowego noworodka a dojrzałym układem dorosłych. Oznacza to, że ustalenie, w jaki sposób chirurdzy i zespoły opiekuńcze mogą podejść do dostosowania sposobu zarządzania opieką pooperacyjną nad noworodkami i małymi dziewczynkami, będzie skomplikowane.
„Prosta zmiana dawek leków przeciwbólowych może nie być rozwiązaniem. Zawsze istnieje równowaga pomiędzy kontrolowaniem bólu a minimalizacją możliwych szkodliwych skutków ubocznych istniejących leków. Zamiast tego nasze odkrycia sugerują, że istnieje potrzeba opracowania bardziej specyficznych, lepiej ukierunkowanych metod leczenia, które mogłyby zapobiec przeprogramowaniu komórek makrofagów w odpowiedzi na uraz” – mówi Jankowski.
Następne kroki
Konieczne są dalsze badania, aby wykorzystać te nowe informacje do opracowania terapii kontrolujących immunologiczne „wspomnienia bólu”.
W tym badaniu zablokowanie receptora p75NTR u młodych myszy faktycznie osłabiło zdolność makrofagów do komunikowania się z neuronami czuciowymi i częściowo zapobiegło długotrwałym zachowaniom bólowym. Nie jest jednak jasne, czy podobne metody można bezpiecznie zastosować do atakowania ludzkich makrofagów.
„Wydaje się, że pojawiające się technologie są w stanie specyficznie blokować receptor p75NTR w makrofagach, ale będzie wymagało znacznie więcej badań, zanim to podejście będzie gotowe do prób klinicznych na ludziach” – mówi Jankowski.
O badaniu
Oprócz Doursona i Jankowskiego współautorami książki Cincinnati Children byli Adewale Fadaka, Anna Warshak, Luis Queme i Megan Hofmann z Oddziału Anestezjologii; Aditi Paranjpe, Oddział Bioinformatyki; Benjamin Weinhaus i Daniel Lucas, Zakład Hematologii Doświadczalnej i Biologii Nowotworów; Heather Evans i George Deepe, Jr., Oddział Chorób Zakaźnych; oraz Omer Donmez, Carmy Forney, Matthew Weirauch i Leah Kottyan, Centrum Genomiki i Etiologii Autoimmunologicznej.
Prace eksperymentalne w ramach tego badania obejmowały wsparcie ze strony Centrum Cytometrii Przepływowej, Centrum Bioobrazowania i Analiz, Centrum Genomiki i Etiologii Autoimmunologicznej oraz Centrum Kompleksowego ds. Myszy i Raka w Cincinnati Children’s.
Finansowanie tego badania obejmowało liczne granty od National Institutes of Health (R01NS105715, R01NS113965, F31NS122494, R01HL160614, P30 AR070549; nagrodę ARC od Cincinnati Children’s oraz wsparcie od Towarzystwa Leukemia and Lymphoma Society).






