Ksenogeny: nowa granica ochrony środowiska wodnego

Ochrona zasobów genetycznych zagrożonych gatunków wodnych nabrała w ostatnich latach coraz większego znaczenia. W wyniku postępu w nauce kriokonserwacji zamrażanie plemników wielu gatunków wodnych stało się dość łatwe, ale dojrzałe komórki jajowe i rozwijające się zarodki to zupełnie inna historia, przynajmniej w przypadku ryb.
Ich stosunkowo duży rozmiar, wysoka zawartość żółtka i ograniczona przepuszczalność błony zwykle sprawiają, że są trudne lub niemożliwe do krioprezerwacji, ale w ostatnich latach wykazano wykonalne obejście problemu. Tkanki i/lub komórki, które ostatecznie rozwijają się w jaja ryb, można krioprezerwować, a następnie rozmrażać i przeszczepiać do sterylnych ryb biorców. Ci zastępczy biorcy mogą być z tego samego gatunku, spokrewnionych gatunków lub w niektórych przypadkach zupełnie niespokrewnionych. Gdy wszystko działa, ryby biorcy rozwijają funkcjonalne gamety męskie lub żeńskie z materiałem genetycznym od pierwotnego dawcy. W rezultacie podejście to oferuje wyraźne korzyści w zakresie ochrony gatunków zagrożonych lub na skraju wyginięcia.
Nauka (uproszczona)
Te nowe granice w ochronie środowiska wodnego koncentrują się na wykorzystaniu komórek rozrodczych i komórek macierzystych gonad, przy czym te ostatnie wyłaniają się jako materiał z wyboru podczas pracy z rybami. Nie wdając się w nadmierne szczegóły, komórki macierzyste są zasadniczo niezróżnicowanymi komórkami, które mogą rozmnażać się w wiele innych komórek tego samego typu, pozostawać uśpione lub różnicować się, aby przejąć określone funkcje. Różne tkanki i narządy, w tym tkanki gonad u ryb, zazwyczaj zawierają pewne komórki macierzyste, które mogą rozwinąć się w nowe, zróżnicowane komórki. Aby krótko podsumować pochodzenie tych tkanek gonad, bardzo wcześnie w rozwoju zarodków ryb można wyróżnić dwa podstawowe typy komórek: komórki rozrodcze i komórki somatyczne. Gdy komórki somatyczne zaczynają tworzyć całość organizmu, komórki rozrodcze trafiają do tkanek, które staną się jajnikami lub jądrami i zaczną się proliferować.
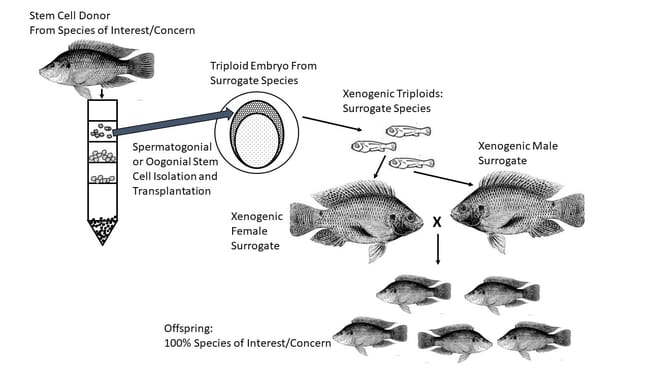
Jeśli komórki macierzyste gonad (lub odpowiednie tkanki spermatogoniów lub oogoniów) od ryb dawców mogą zostać zamrożone i pomyślnie odzyskane, można je wprowadzić do osobników zastępczych, gdzie będą funkcjonować tak jak komórki rozrodcze, migrując do odpowiedniej lokalizacji wewnętrznej i rozwijając się w funkcjonalne gonady (Yoshizaki i Lee 2018). Ryby biorcy są wcześniej sterylizowane, albo poprzez indukcję triploidii, albo poprzez supresję natywnych komórek gonad. A w wielu przypadkach biorcy mogą pochodzić z wyraźnie różnych gatunków. Kiedy biorcy są innego gatunku niż dawca, nawet jeśli są blisko spokrewnieni, są określani jako „ksenogeny”. Wiele ostatnich wyników badań potwierdza, że podejście to stanowi potężne nowe narzędzie do konserwacji zasobów genetycznych u wielu gatunków ryb.
Czy to naprawdę działa?
W 2010 roku Lacerda i in. donieśli o próbach przeprowadzenia transplantacji komórek macierzystych spermatogoniów u tilapi. Przeszczepili świeże lub kriokonserwowane komórki macierzyste z jednego szczepu tilapi do wcześniej wysterylizowanych samców innego szczepu. Kriokonserwowane komórki macierzyste rozwinęły się w plemniki u ryb biorców, ze wskaźnikiem kolonizacji wynoszącym 88 procent. Samce biorców ostatecznie wyprodukowały żywe plemniki i spłodziły potomstwo o genotypie szczepu dawcy.
W tym samym roku Yoshizaki i in. wykazano, że po przeszczepieniu do świeżo wyklutego narybku komórki jajowe pstrąga tęczowego ostatecznie różnicowały się w jaja u samic i plemniki u samców. Podobne wyniki odnotowano u innych ryb, a ta plastyczność oparta na biorcy może również zapewnić alternatywne podejście do hodowli monoseksualnej u wielu gatunków.
© Greg Lutz
W 2012 roku Lee i in. byli w stanie przeszczepić wcześniej zamrożone spermatagonia do triploidalnych pstrągów tęczowych. Prawie połowa tych ryb wyprodukowała funkcjonalne jaja lub plemniki, w zależności od ich płci fenotypowej, co w połączeniu skutkowało normalnym potomstwem. Podobnie, w 2016 roku Lee i Yoshizaki zademonstrowali kriokonserwację, rozmrażanie i przeszczepianie komórek jąder zagrożonego pstrąga mandżurskiego do triploidalnych młodych biorców tego samego gatunku. Przeszczepione spermatogonia migrowały i były włączane do tkanki gonad triploidów, przy czym niektórzy biorcy rozwijali dojrzewające jądra, podczas gdy inni produkowali dojrzewające jajniki. Należy zachować ostrożność, w rzeczywistych warunkach takie podejście wymagałoby wielu dawców komórek macierzystych w celu zminimalizowania wpływu chowu wsobnego, przy czym ksenogeny od jednego dawcy byłyby rozmnażane razem z ksenogenami od innych dawców.
Idziemy o krok dalej z inną zagrożoną rybą, Psenicką i in. (2016) wykorzystali wczesną fazę tkanki jąder i jajników oraz komórki jesiotra syberyjskiego do oceny różnych protokołów obsługi i zamrażania. Zarówno cała tkanka, jak i rozdzielone komórki wykazywały dobrą przeżywalność po rozmrożeniu. Po przeszczepieniu do larw sterleta, po 90 dniach rozmnożyły się u ponad połowy biorców. I dalej przesuwając granice filogenetycznej odległości między dawcami i biorcami, Silva i in. (2016) z powodzeniem przeszczepiono komórki macierzyste spermatogoniów z suma Jundia (Rhamdia królewska) do samca tilapi nilowej. Samce tilapi zostały wysterylizowane przed przeszczepem za pomocą wysokich temperatur i zastrzyków bisulfanu. Do 120. dnia po zabiegu wszystkie ryby biorcy zaczęły produkować plemniki.
Karp pospolity jest jednym z najczęściej hodowanych gatunków w wodach śródlądowych i przez setki lat opracowano wiele odrębnych szczepów. Pojawiły się obawy, że niektóre z tych „dziedzicznych” odmian mogą zostać utracone, jeśli nie zostaną zachowane. Pracując z komórkami oogonialnymi, Franek i in. (2019) dostarczyli dogłębnego przeglądu procedur kriokonserwacji w celu zachowania zasobów genetycznych u tego gatunku. Co ciekawe, niedojrzałe dawczyni wykazujące wczesne stadia rozwoju jajników zapewniły najlepsze wyniki kriokonserwacji, prawdopodobnie ze względu na to, że ich komórki nadal miały odpowiedni poziom przepuszczalności błony. Yaraş i Çek-Yalniz (2021) również zgłosili wyższy sukces przy izolowaniu komórek macierzystych oogonium od młodych pstrągów potokowych o długości około 15 cm.
Niedawno Ye i in. (2020) opracowali procedurę kriokonserwacji komórek macierzystych gonad amerykańskiego wiosłonosa i jesiotra Jangcy. Po roku przechowywania w kriokonserwacji komórki te rozmrożono i przeszczepiono do larw jesiotra, gdzie zostały pomyślnie włączone. Te odkrycia, wraz z odkryciami Psenicka i in. (2016) są szczególnie zachęcające, jeśli weźmiemy pod uwagę, że Międzynarodowa Unia Ochrony Przyrody uznaje około 80 procent gatunków jesiotrów i wiosłonosów za zagrożone lub krytycznie zagrożone.

© Dr Chris Green
Witryfikacja igłowa
Istnieją tysiące odrębnych linii danio pręgowanego w badaniach biomedycznych, a co miesiąc powstają nowe. Mając na celu bardziej efektywną konserwację plazmy zarodkowej danio pręgowanego, Marinović i in. (2018) przedstawili wykonalną metodę kriokonserwacji wczesnych stadiów komórek rozrodczych danio pręgowanego przy użyciu spermatogonii i witryfikacji igłowej (NIV). W badaniu uzupełniającym grupa przedstawiła więcej wyników NIV z wysokim wskaźnikiem powodzenia. NIV oferuje pewne wyraźne zalety podczas kriokonserwacji małych próbek tkanek. Wymagania dotyczące krioochronnych środków są zmniejszone, ponieważ próbki tkanek są przypinane do igły akupunkturowej, umieszczane w środowisku krioochronnym, a następnie usuwane i umieszczane w roztworze witryfikacji, a następnie zanurzane bezpośrednio w ciekłym azocie.
Kilku tych samych badaczy z Marinović i in. badania wymienione powyżej już w 2017 r. informowały o optymalizacji protokołów NIV dla tkanki jajnika łososiowatych, w szczególności tkanki jajnika młodych pstrągów potokowych. A w 2022 r. część tej samej grupy badawczej informowała o stosowaniu NIV z wykorzystaniem tkanki jajnika u jesiotrów Acipenser ruthenus I A. gueldenstaedtiiRozmrożone komórki skutecznie skolonizowały gonady ryb-biorców, a wyniki potwierdziły, że NIV jest dodatkowym narzędziem w ochronie zagrożonych gatunków jesiotra.
Produkcja akwakultury
Oprócz inicjatyw konserwacyjnych, wykorzystanie zastępczego stada hodowlanego oferuje szereg potencjalnych korzyści dla poprawy genetycznej w akwakulturze. Ryby o lepszych lub unikalnych cechach mogą dostarczać komórki do transplantacji do wielu biorców, znacznie zwiększając produkcję wybranego potomstwa. Możliwe jest również wykorzystanie gatunków biorców o stosunkowo krótkich odstępach między pokoleniami w celu przyspieszenia programów selekcji dla gatunków dawców, które wymagają dłuższego czasu, aby osiągnąć dojrzałość. A gdy pożądane są hybrydowe stada produkcyjne, technologie ksenogeniczne mogą oferować praktyczną alternatywę dla sztucznego tarła na dużą skalę.
W USA hodowla sumów stała się w dużym stopniu zależna od hodowli hybrydowych uzyskanych przy użyciu sumika błękitnego (Ictalurus furcatus) samce i sumiki kanałowe (I. punctatus) samice. Te hybrydy oferują lepsze cechy pod względem wzrostu, konwersji paszy i odporności na choroby. Niestety, muszą być sztucznie produkowane w wylęgarniach z powodu niezgodności behawioralnych, które skutkują ograniczonym i w dużej mierze zawodnym tarłem wolicjonalnym między gatunkami rodzicielskimi. A ponieważ samce suma błękitnego nie mogą być rozmnażane pasowo, muszą być poświęcane w tym procesie, co znacznie zwiększa roczne zapotrzebowanie na samce stada zarodowego. Naukowcy z Uniwersytetu w Auburn rozpoczęli ocenę wykorzystania metod ksenogenicznych w celu rozwiązania tej sytuacji kilka lat temu, a ich postępy są imponujące.

© Dr Chris Green
Perera i in. (2017) opublikowali pierwszy raport o ksenogenicznej produkcji hybryd kanałowych x niebieskich, choć z bardzo ograniczonymi wynikami. Przeszczepili spermatogonia niebieskiego suma do triploidalnego samca suma kanałowego, a dwa lata później zebrali plemniki od jednego z tych ksenogenów i z powodzeniem użyli ich do zapłodnienia jaj suma kanałowego, co zaowocowało potomstwem hybrydowym. Niedługo potem Shang i in. doniesiono o izolacji i udanej transplantacji komórek rozrodczych jąder sumika błękitnego do blastuli sumika kanałowego. Teoretycznie powstałe ksenogeniczne samce sumika kanałowego mogłyby się naturalnie rozmnażać z samicami sumika kanałowego każdego roku po osiągnięciu dojrzałości, produkując hybrydowe potomstwo w ilościach komercyjnych.
Do 2020 r. Abualreesh i in. opracowano i opublikowano niezawodny protokół dotyczący mrożenia spermatogoniów sumika błękitnego, z dodatkowymi udoskonaleniami
w 2021 r. Zdając sobie sprawę, że posiadanie zamrożonych komórek macierzystych w repozytoriach miałoby realny potencjał do przyspieszenia produkcji hybrydowych sumów na skalę komercyjną, naukowcy z Auburn naciskali dalej i do 2022 r. Hettiarachchi i in. zaprezentowano produkcję ksenogenów sumika kanałowego przy użyciu kriokonserwowanych tkanek jąder i jajników sumika błękitnego.
Badania te są kontynuowane w Auburn, a metody i protokoły są stale udoskonalane, ale mogą pojawić się również nowe zastosowania. Zazwyczaj ikry rybiej nie uważa się za szczególnie cenny towar, z wyjątkiem kawioru. Zwłaszcza kawioru z jesiotra. W 2023 roku Jacob Al-Armanazi ukończył pracę magisterską w Auburn. Jednym z celów jego badań było przeszczepianie komórek macierzystych oogonium i spermatogonia z jesiotra jeziornego do triploidalnego suma hybrydowego (suma białego x suma niebieskiego) oraz z jesiotra syberyjskiego do triploidalnego suma kanałowego. Prawie 89 procent biorców sumów hybrydowych wykazywało proliferację komórek macierzystych jesiotra jeziornego i chociaż wyniki nie były tak imponujące w przypadku przeszczepionych sumów kanałowych, komórki macierzyste jesiotra syberyjskiego przetrwały u prawie 77 procent biorców.
Podsumowując, w miarę jak nasze zrozumienie i opanowanie produkcji ksenogenicznej u ryb postępuje, może to przynieść szereg korzyści. Ochrona i zachowanie plazmy zarodkowej będzie nadal stanowić istotną kwestię na całym świecie, dla wszystkich osób pracujących z zagrożonymi i ginącymi gatunkami ryb, a także dla szeregu sektorów w ramach komercyjnej akwakultury. W nadchodzących latach kriokonserwacja i późniejsza transplantacja komórek macierzystych gonad nabiorą coraz większego znaczenia u szeregu gatunków ryb.