Masakra komarów: Czy możemy bezpiecznie zwalczać malarię, stosując technologię CRISPR?

Zamiast zmieniać gen wpływający na produkcję hormonu rozrodczego, edycja ma bardziej fundamentalny cel: gen, który determinuje płeć. Praca została wykonana przez Andreę Crisanti i współpracowników z Imperial College London. Ich sprytne wykorzystanie starożytnej mutacji owada doublesex zadzwoniło do mnie — używałem wersji muszki owocowej na studiach podyplomowych.
Wybuch z przeszłości
W czasach przed sekwencjonowaniem genomu genetycy tworzyli mutanty w organizmach modelowych, takich jak muszki owocowe, aby odkryć funkcje genów. Pracowałem nad mutacjami, które mieszają części ciała.

Aby stworzyć mutanty, trułem larwy lub taszczyłem je, wijąc się przez maź w ich staromodnych butelkach po mleku, z laboratorium na Uniwersytecie Indiany w Bloomington do dziecięcego centrum onkologicznego w Indianapolis i raziłem je promieniami rentgenowskimi. Skrzyżowanie dorosłych larw z muchami, które przenosiły już znane mutacje, ujawniłoby, czy wywołaliśmy coś interesującego u ich potomstwa. Jedną z mutacji, których użyliśmy w tych badaniach genetycznych, była mutacja doublesex.
Zestaw genów determinuje płeć u owadów, a nie tylko dziedziczenie chromosomu X lub Y. Doublesex działa na skrzyżowaniu dróg rozwojowych, aby wybrać ścieżkę prowadzącą do kobiecości lub męskości. Gdy gen jest nieobecny lub zmutowany, muchy wykazują mieszaninę części seksualnych i zmienione zachowanie. Samce z mutacjami doublesex „mają upośledzoną chęć zalecania się do samic”, zgodnie z jednym z badań, a gdy już szukają seksu, nie potrafią odpowiednio nucić i „zalecać innych samców na nienormalnie wysokim poziomie”.
W tamtych czasach używaliśmy doublesex jako narzędzia do identyfikacji nowych mutacji. Nigdy nie wyobrażaliśmy sobie, że będzie ono używane do zapobiegania chorobie zakaźnej, która powoduje prawie pół miliona zgonów rocznie, głównie wśród małych dzieci.
Napęd genetyczny zniekształca dziedziczenie, niszcząc płodność
Na studiach podyplomowych hodowaliśmy muchy przez wiele pokoleń, aby wybrać cechę, ponieważ mutacja u nosiciela przechodzi tylko na połowę potomstwa. Napęd genowy przyspiesza działanie, igrając z pierwszym prawem Mendla, które mówi, że w każdym pokoleniu każdy członek pary wariantów genu (allele) jest wysyłany do plemnika lub komórki jajowej z równą częstotliwością.
Austin Burt, współautor nowego artykułu, przedstawił pomysł napędu genowego w 2003 r., przed CRISPR. Interwencja ta wykorzystuje wersję naturalnej naprawy DNA, która wycina jedną kopię genu i zastępuje ją kopią dowolnego odpowiadającego allelu znajdującego się na sparowanym chromosomie. Wyobraź sobie partnerów tanecznych, usuwających jednego i wstawiających identycznego bliźniaka drugiego.
W języku genetyki napęd genowy może zmienić heterozygotę (2 różne kopie genu) w homozygotę (2 identyczne kopie).
W 2014 r. Kevin Esvelt, George Church i ich koledzy z Harvardu zasugerowali, jak wykorzystać edycję genów CRISPR-Cas9 do przyspieszenia napędu genowego. Miało to tyle sensu, że w 2016 r. Narodowe Akademie Nauk, Inżynierii i Medycyny wydały raport wzywający do ostrożności, jednocześnie popierając dalsze eksperymenty laboratoryjne i ograniczone próby terenowe napędów genowych.
Pomysł genetycznego sparaliżowania rozmnażania komarów nie jest nowy. Ale napęd genetyczny CRISPRed, który by to zrobił, byłby szybki, prowadząc do masowej bezpłodności w ciągu kilku pokoleń, a populacja gwałtownie zmierzałaby w kierunku wyginięcia. A doublesex jest zainspirowanym celem. Jest tak ważny, że tylko jeden wariant w Anopheles gambiae jest znany w naturze — wszelkie inne mutacje tak osłabiają zwierzęta, że one i ich geny nie przetrwają. Dlatego gen nie może zmutować się z powrotem i zacząć działać, jak bakterie rozwijające oporność na antybiotyki. W przypadku doublesex oporność jest daremna.
Wykorzystanie podwójnego seksu
Gen doublesex składa się z 7 eksonów kodujących białka i intronów, które je rozdzielają. Gen jest alternatywnie splicingowany: komary utrzymujące ekson 5 stają się samicami, a te, które pozbywają się eksonu, rozwijają się jako samce.
Naukowcy wstrzyknęli zarodkom komarów CRISPR-Cas9 zmodyfikowany tak, aby harpunować granicę między intronem 4 a eksonem 5 genu doublesex. Dodali instrukcje genetyczne dla czerwonego białka fluorescencyjnego na chromosomie Y, aby oznaczyć męskie gonady, dzięki czemu naukowcy mogli rozróżnić płeć.
Zmodyfikowane samice komarów były dziwne. Posiadały męskie narządy kleszczowe obrócone w złą stronę i brakowało im części repertuaru żeńskich narządów płciowych. Miały pierzaste, męskie „pierzaste czułki”, ani jajniki, ani żeńskie pojemniki na plemniki, ale męskie gruczoły dodatkowe, a u niektórych osobników „prymitywne gruszkowate narządy przypominające nieustrukturyzowane jądra”. Co najważniejsze, poddane obróbce samice nie mogły gryźć ani wysysać krwi.
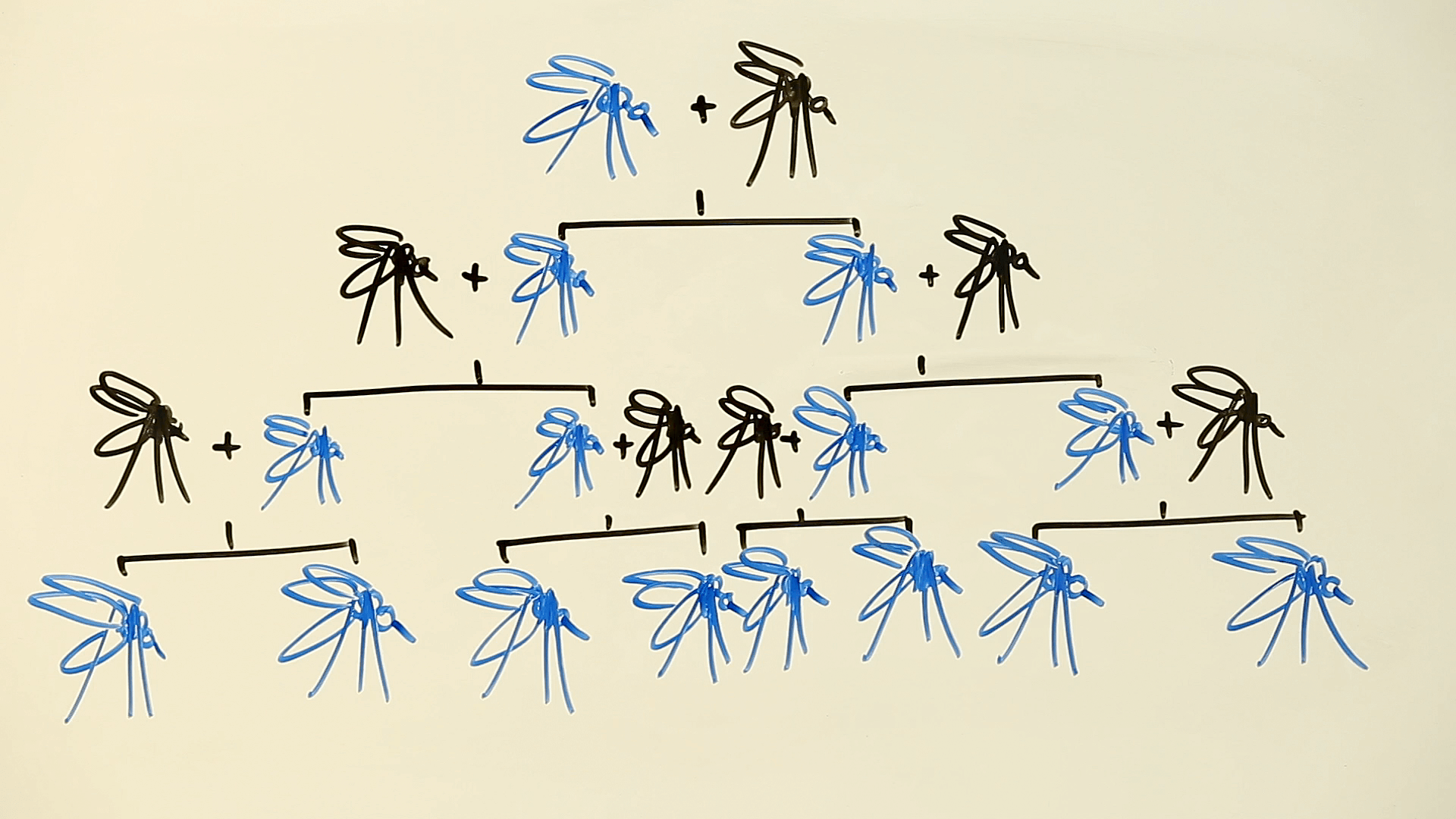
Naukowcy ustawili dwie klatki, w każdej z których znajdowało się 300 samic z normalnymi genami doublesex, 150 normalnych samców i 150 samców z jedną kopią normalnego doublesex i jedną zmodyfikowaną kopią, zwaną CRISPRh. Następnie owady kopulowały. (Aby zapoznać się z fascynującym opisem seksu much, zobacz Historia miłosna muszki owocówki: narodziny mutanta.)
W ciągu 7 pokoleń w jednej klatce i 11 w drugiej wszystkie samice much miały CRISPRh i nie mogły się rozmnażać. Ponieważ samce z jedną kopią CRISPRh są płodne, populacje rozwijały się, aż napęd genetyczny uczynił wszystkie samice homozygotycznymi. Mając dwie kopie zmodyfikowanego genu doublesex, nie mogły jeść ani się rozmnażać.
Następne kroki
Edycja genów doublesex stawia pytanie o równowagę. Badacze nazywają to „piętą achillesową” wspólną dla wielu gatunków owadów, ale jednocześnie sekwencje DNA są na tyle specyficzne dla gatunku, że nie rozprzestrzeniają się na inne rodzaje owadów. Napęd genowy, który zabija pszczoły lub mszyce, byłby na przykład katastrofalny.
Następnie nastąpią eksperymenty w „dużych, zamkniętych przestrzeniach”, bardziej przypominających naturę. Zamknięte komary nie mają wiele do roboty poza rozmnażaniem się. W bardziej naturalnym otoczeniu musiałyby konkurować o zasoby i partnerów, stawiać czoła zmieniającym się warunkom i unikać zjedzenia. Jednak symulacje komputerowe sugerują, że dodanie tych stresów tylko nieznacznie spowolniłoby rozprzestrzenianie się napędu genowego.
Według naukowców testy terenowe odbędą się za 5 do 10 lat. Dr Burt szacuje, że wypuszczenie kilkuset zmodyfikowanych komarów na raz do wybranych afrykańskich wiosek może doprowadzić do wystarczającego zmniejszenia populacji, aby je wytępić, nawet na szerszym obszarze. Lokalna eradykacja malarii zajęłaby około 15 lat, gdy tylko rozpocznie się napęd genetyczny, przewiduje.

Czy natura znajdzie sposób na obejście napędu genetycznego?
A co z „nieprzewidzianymi konsekwencjami” uwolnienia napędu genowego w celu pokonania komarów roznoszących malarię? Cytując fikcyjnego matematyka Iana Malcolma w dyskusji o sklonowanych dinozaurach z Parku Jurajskiego: „Twoi naukowcy byli tak zajęci tym, czy mogą, że nie zatrzymali się, żeby pomyśleć, czy powinni”.
Przeszliśmy etap „mogłoby” z napędem genetycznym opartym na podwójnej płci przeciwko komarom. Ale może nie powinniśmy ignorować historii biotechnologii. Chociaż żadne superbakterie ani trójgłowe fioletowe potwory nie uciekły z laboratoriów rekombinacji DNA od czasu rozpoczęcia samokontroli na spotkaniu Asilomar w 1975 r., pyłek z genetycznie modyfikowanych upraw ma unosił się daleko poza pola uprawne. Czasami, jak powiedział dr Malcolm, „życie, uh, znajduje sposób”.
Jednak ciężkość i uporczywość malarii mogą uzasadniać ryzyko nieprzewidzianych konsekwencji w przypadku opracowania napędu genetycznego.
Około 216 milionów przypadków malarii wystąpiło na świecie w 2016 roku, z szacunkową liczbą 445 000 zgonów, zgodnie z raportem WHO World Malaria Report 2017, który stwierdza, że „po bezprecedensowym okresie sukcesów w globalnej kontroli malarii, postęp utknął w martwym punkcie”. Dr Crisanti powiedział, że „rok 2016 był pierwszym od ponad dwóch dekad, kiedy liczba przypadków malarii nie spadła pomimo ogromnych wysiłków i zasobów, co sugeruje, że potrzebujemy więcej narzędzi w tej walce. Ten przełom pokazuje, że napęd genetyczny może działać, dając nadzieję w walce z chorobą, która nęka ludzkość od wieków”.
Podobnie jak rekombinowane DNA weszło do kliniki w 1982 r. wraz z zatwierdzeniem przez FDA ludzkiej insuliny produkowanej w bakteriach, pierwszy napęd genowy, cokolwiek by nie dostarczał, mógłby otworzyć drzwi dla wielu innych, tak jak dziesiątki leków opierają się obecnie na łączeniu genów różnych gatunków. Doublesex, mutacja, której używałem na studiach podyplomowych do przesiewania nowych mutacji, jest jednym z tysięcy genów u tego jednego gatunku. Jeśli i kiedy napędy genowe zostaną zweryfikowane, możliwości ograniczenia lub wyeliminowania chorób zakaźnych są niemal nieograniczone, dzięki zestawom narzędzi genetycznych dostarczonym przez dziesięciolecia badań podstawowych.
Ricki Lewis ma doktorat z genetyki i jest autorką tekstów naukowych oraz kilku książek o genetyce człowieka. Jest profesorem nadzwyczajnym w Alden March Bioethics Institute w Albany Medical College. Obserwuj ją na jej stronie internetowej lub Twitterze @rickilewis
Artykuł pierwotnie opublikowano w GLP 2 października 2018 r.






