Naukowcy łączą poziom białka z poważnymi niedoborami intelektualnymi
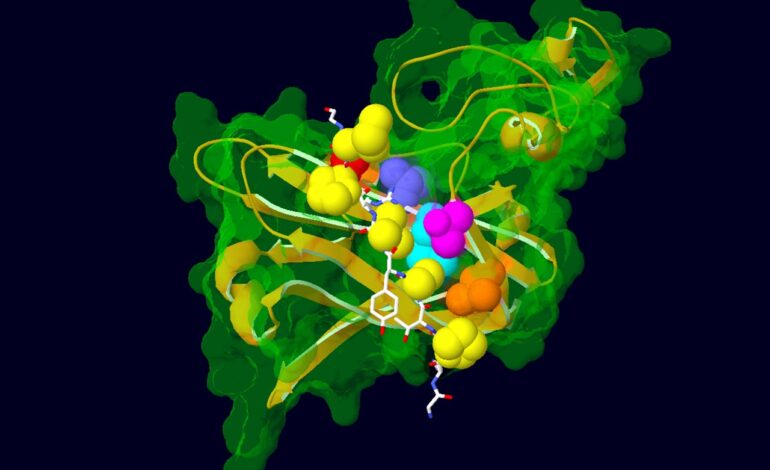
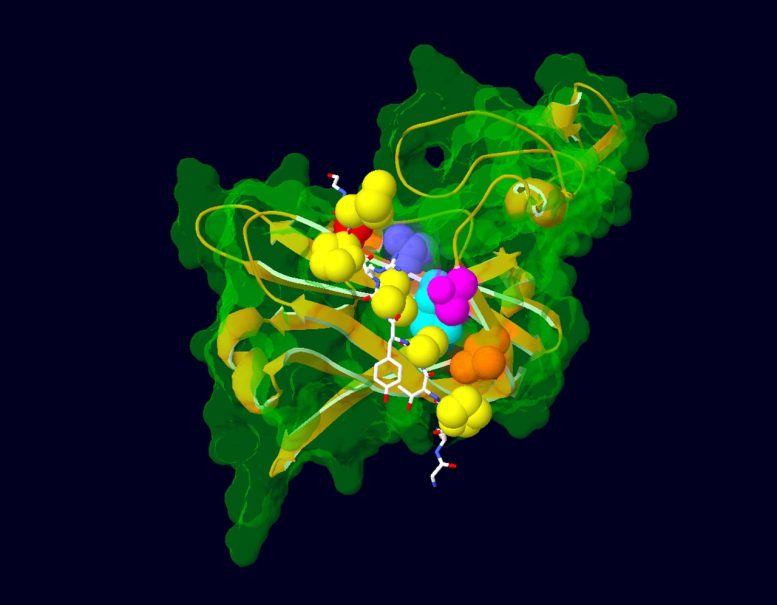
Model pokazujący interakcję pomiędzy częścią białka AFF3 (na biało) a ligazą ubikwitynową (na zielono i złocie), białkiem regulującym jego degradację. Aminokwasy zmutowane u pacjentów z zespołem KINSSHIP pokazano jako żółte atomy. Aminokwasy ligazy ubikwitynowej, z którymi oddziałują, są przedstawione jako kolorowe atomy. Źródło: Nicolas Guex © UNIL
Nowe badania pokazują, że zarówno nadmiar, jak i niedobór pojedynczego białka mogą prowadzić do poważnych niedoborów intelektualnych. Odkrycie dostarcza kluczowych informacji umożliwiających wczesną diagnostykę rzadkich zaburzeń rozwojowych.
Zespół naukowców stanowi ogromny krok naprzód w wykrywaniu rzadkiej choroby genetycznej. Naukowcy po raz pierwszy wykazali, że zarówno akumulacja, jak i niedobór tzw. białka AFF3 są szkodliwe dla rozwoju. Badaniami kierował Alexandre Reymond, ekspert w dziedzinie genetyki człowieka w Centrum Integracyjnej Genomiki (CIG) i profesor na Wydziale Biologii i Medycyny (FBM) Uniwersytetu w Lozannie (UNIL).
Wyniki badania, opublikowane dzisiaj (30 maja) w Medycyna genomujest kontynuacją odkrycia przez tę grupę w 2021 r. zespołu KINSSHIP, spowodowanego mutacjami w AFF3 genu i powodujący niepełnosprawność intelektualną, zwiększone ryzyko epilepsji, wad rozwojowych nerek i deformacji kości u chorych dzieci.
Odkrycie genetycznej przyczyny zespołu KINSSHIP
Zespół KINSSHIP dotyka około trzydziestu osób na całym świecie. W rezultacie istnieje niewiele udokumentowanych przypadków, a zrozumienie choroby pozostaje ograniczone, co utrudnia wczesną i dokładną diagnozę.
„W naszym poprzednim badaniu wykazaliśmy, że ta patologia wynika z nieprawidłowej akumulacji białka AFF3. Tymczasem dostępne dane genetyczne pochodzące od osób z populacji ogólnej sugerują, że brak tego samego białka może być podobnie szkodliwy” – wyjaśnia dr Sissy Bassani, badaczka ze stopniem doktora w zespole profesora Reymonda i główna autorka obecnego badania.
Duża baza danych genomu wskazuje badaczom nową hipotezę
Genetycy sformułowali swoją hipotezę, korzystając z gnomAD – bazy danych zawierającej sekwencje genomów kilkuset tysięcy niespokrewnionych osobników. Eksplorując dostępne dane dla AFF3 Naukowcy odkryli, że mutacje powodujące utratę funkcji w tym genie są rzadkie, co wskazuje na ich prawdopodobną szkodliwość. Oznacza to, że gen ten odgrywa kluczową rolę, a jego utrata prawdopodobnie będzie miała szkodliwe konsekwencje dla organizmu.
Aby przetestować swoją hipotezę, autorzy poszukiwali osób posiadających tylko jedną kopię genu zamiast dwóch normalnie występujących w ludzkim genomie. Współpracując z badaczami z dziewięciu różnych krajów w Europie i Ameryce Północnej, zidentyfikowali 21 pacjentów z taką anomalią. Wszyscy wykazali podobne, ale mniej nasilone objawy niż u pacjentów z zespołem KINSSHIP.
Eksperymenty ujawniają wpływ rozwojowy AFF3 mutacje genowe
Aby wykazać, że zarówno niewystarczające, jak i nadmierne ilości AFF3 są szkodliwe, badacze wykorzystali kilka różnych systemów eksperymentalnych: komórki pacjentów, myszy i danio pręgowanego. Sztuczne zmniejszanie lub zwiększanie ilości białka w jajach danio pręgowanego ujawniło poważne wady rozwojowe powstałych zarodków ryb.
„Wyniki te potwierdzają, że dokładna ilość AFF3 ma kluczowe znaczenie dla prawidłowego rozwoju embrionalnego oraz że mutacje wpływające na jego funkcję i/lub dawkowanie powodują poważne wady rozwojowe” – podsumowuje prof. Reymond.
Wpływ na diagnostykę prenatalną
Odkrycia autorów stanowią ważny postęp w diagnostyce tego rzadkiego zaburzenia, jakim jest badanie AAF3 mutacje podczas rozwoju płodu mogą poprawić wczesne wykrywanie tych defektów genów.
Odniesienie: „Specyficzne dla wariantu mechanizmy patofizjologiczne AFF3 w różny sposób wpływają na profile transkryptomu” autorstwa Sissy Bassani, Jacqueline Chrast, Giovanna Ambrosini, Norine Voisin, Frédéric Schütz, Alfredo Brusco, Fabio Sirchia, Lydia Turban, Susanna Schubert, Rami Abou Jamra, Jan-Ulrich Schlump, Desiree DeMille, Pinar Bayrak-Toydemir, Gary Rex Nelson, Kristen Nicole Wong, Laura Duncan, Mackenzie Mosera, Christian Gilissen, Lisenka ELM Vissers, Rolph Pfundt, Rogier Kersseboom, Hilde Yttervik, Geir Åsmund Myge Hansen, Marie Falkenberg Smeland, Kameryn M. Butler, Michael J. Lyons, Claudia MB Carvalho, Chaofan Zhang, James R. Lupski, Lorraine Potocki, Leticia Flores-Gallegos, Rodrigo Morales-Toquero, Florence Petit, Binnaz Yalcin, Annabelle Tuttle, Houda Zghal Elloumi, Lane McCormick, Mary Kukolich, Oliver Klaas, Judit Horvath, Marcello Scala, Michele Iacomino, Francesca Operto, Federico Zara, Karin Writzl, Aleš Maver, Maria K. Haanpää, Pia Pohjola, Harri Arikka, Anneke JA Kiewit, Camilla Calandrini, Christian Iseli, Nicolas Guex i Alexandre Reymond, 30 maja 2024 r., Medycyna genomu.
DOI: 10.1186/s13073-024-01339-y






