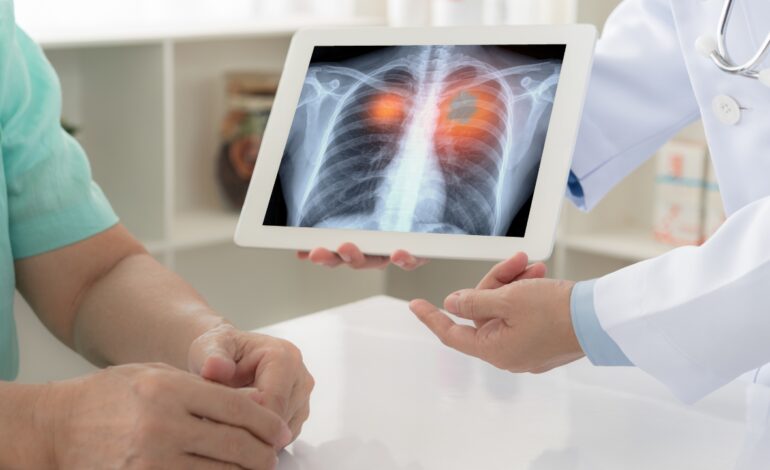
Naukowcy obalają panującą teorię inicjacji nowotworu jelita grubego
Badania prowadzone przez Weill Cornell Medicine dostarczają nowych dowodów na to, że większość nowotworów jelita grubego zaczyna się od utraty jelitowych komórek macierzystych, nawet zanim pojawią się zmiany genetyczne powodujące raka. Wyniki opublikowano 29 maja br Komórka Rozwojowa, obalić panującą teorię inicjacji nowotworu jelita grubego i zaproponować nowe sposoby diagnozowania choroby, zanim ma ona szansę się utrwalić.
„Rak jelita grubego jest bardzo, bardzo niejednorodny, co przez wiele lat utrudniało klasyfikację tych nowotworów na potrzeby terapii” – powiedział starszy autor, dr Jorge Moscat, Homer T. Hirst III, profesor patologii onkologicznej i wiceprzewodniczący patobiologii komórek i nowotworów na Wydziale Patologii i Medycyny Laboratoryjnej w Weill Cornell Medicine. Ta heterogeniczność, zróżnicowana charakterystyka komórek nowotworu jelita grubego u różnych pacjentów, a także w obrębie tego samego nowotworu, sprawia, że leczenie jest szczególnie trudne.
Guzy jelita grubego mogą wynikać z dwóch typów polipów przednowotworowych: gruczolaków konwencjonalnych i gruczolaków ząbkowanych. Uważano, że konwencjonalne gruczolaki rozwijają się w wyniku mutacji w prawidłowych komórkach macierzystych znajdujących się na dnie krypt jelitowych – strukturach przypominających jamę w wyściółce jelita. Z drugiej strony gruczolaki ząbkowane są powiązane z innym typem komórek macierzystych o cechach płodowych, które w tajemniczy sposób pojawiają się na szczytach krypt. Naukowcy w tej dziedzinie opisali te pozornie odrębne procesy powstawania nowotworu jako „oddolne” i „odgórne”.
„Chcieliśmy ustalić, jak naprawdę rozpoczynają się te dwie drogi i jak postępują, abyśmy mogli lepiej zrozumieć ich heterogeniczność w miarę postępu nowotworu” – powiedziała współautorka dr Maria Diaz-Meco, Homer T. Hirst profesor onkologii i patologii na Wydziale Patologii i Medycyny Laboratoryjnej w Weill Cornell Medicine oraz członek Meyer Cancer Center w Weill Cornell Medicine. Jest to szczególnie ważne w przypadku guzów ząbkowanych, które lekarze czasami przeoczają ze względu na ich początkowy płaski kształt, a które później mogą przekształcić się w agresywny nowotwór.
Współpierwszymi autorami są dr Hiroto Kinoshita i dr Anxo Martinez-Ordoñez, współpracownicy ze stopniem doktora na Wydziale Patologii i Medycyny Laboratoryjnej w Weill Cornell Medicine.
Dotarcie do sedna raka jelita grubego
Naukowcy odkryli wcześniej, że wiele ludzkich nowotworów jelita grubego obojga rodzajów ma nienormalnie niski poziom białek zwanych atypową kinazą białkową C (aPKC). W nowym badaniu sprawdzano, co się dzieje, gdy geny aPKC ulegną inaktywacji w modelach zwierzęcych i hodowanych organoidach jelitowych.
„Podeszliśmy do tego projektu, stosując teorię oddolną i odgórną, ale ze zdziwieniem odkryliśmy, że oba typy nowotworów wykazały utratę jelitowych komórek macierzystych po inaktywacji genów aPKC” – powiedział dr Moscat, który jest również członkiem zespołu w Centrum Onkologii Sandry i Edwarda Meyerów w Weill Cornell Medicine.
Charakterystyczne komórki macierzyste górnej części gruczolaków ząbkowanych powstają dopiero po tym, jak normalne komórki macierzyste na dnie krypty obumierają, wprowadzając chaos w strukturze całej krypty. „Tak więc konwencjonalny rak działa oddolnie i rak ząbkowany również działa oddolnie” – stwierdził dr Moscat.
Odkrycia sugerują nowy, ujednolicony model inicjacji raka jelita grubego, w którym uszkodzenie krypt jelitowych powoduje zmniejszenie ekspresji białka aPKC, a następnie utratę normalnych komórek macierzystych na dnie krypt. Bez tych komórek macierzystych komórki krypt nie mogą się regenerować. Aby przetrwać, struktura może stworzyć zastępczą populację regeneracyjnych komórek macierzystych na dole lub więcej płodopodobnych komórek macierzystych na górze. Te komórki zastępcze mogą następnie prowadzić do raka.
Gdybyśmy lepiej zrozumieli, w jaki sposób regulowana jest ekspresja białka aPKC, moglibyśmy kontrolować rozwój nowotworu i zapobiegać mu, a także lepiej zrozumieć postęp nowotworu”.
Dr Maria Diaz-Meco, Homer T. Hirst profesor onkologii w patologii, Katedra Patologii i Medycyny Laboratoryjnej, Weill Cornell Medicine
Zespół bada obecnie wzorce ekspresji aPKC w ludzkich nowotworach na różnych etapach, mając nadzieję na opracowanie testów molekularnych, które można będzie wykorzystać do wcześniejszego wykrywania nowotworów, klasyfikowania nowotworów u pacjentów i opracowania lepszych metod leczenia.
Źródło:
Numer czasopisma:
Kinoshita, H., i in. (2024) Niedobór nabłonkowej aPKC prowadzi do utraty komórek macierzystych poprzedzającej metaplazję w inicjacji raka jelita grubego. Komórka Rozwojowa. doi.org/10.1016/j.devcel.2024.05.001.