Naukowcy odkrywają nową genetyczną przyczynę ciężkiej złożonej choroby niedoboru odporności
Kredyt: Amerykański dziennik genetyki człowieka (2024). DOI: 10.1016/j.ajhg.2024.02.013
× zamknąć
Kredyt: Amerykański dziennik genetyki człowieka (2024). DOI: 10.1016/j.ajhg.2024.02.013
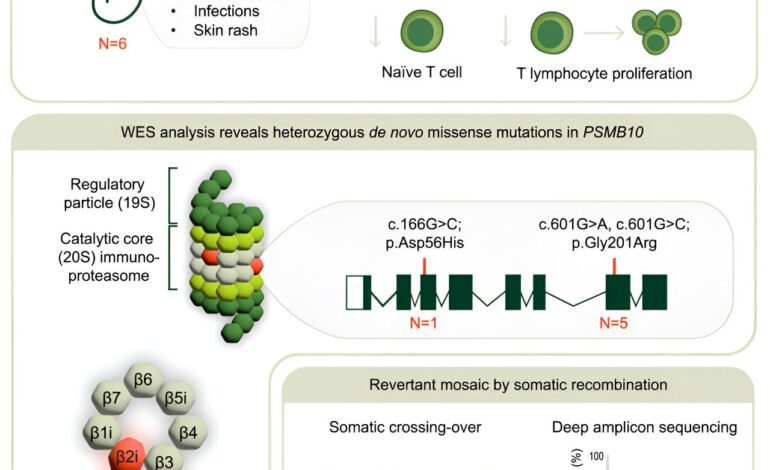
Naukowcy z Nijmegen i Newcastle odkryli nową mutację genetyczną prowadzącą do ciężkiego złożonego zespołu niedoboru odporności (SCID). Po raz pierwszy mutację w proteasomie, niszczącym molekuły, powiązano z tą poważną chorobą.
Jest to prawdopodobnie najbardziej znana rzadka choroba. Wciąż młody John Travolta (Grease, Pulp Fiction itp.) gra nastolatka dorastającego z chorobą w filmie „Chłopiec w plastikowej bańce”. Muzyk Paul Simon nawiązuje do tego w swoim przebojowym utworze „The Boy in the Bubble” zaczerpniętym z albumu „Graceland”. Historie o takich osobach przykuły uwagę opinii publicznej w latach 70. i 80. XX wieku, skrystalizując się wokół dramatycznej historii życia Davida Vettera.
To zainteresowanie nie było zaskoczeniem. Dla Vettera i wszystkich innych osób chorych jedynym sposobem na przeżycie było zamknięcie w sterylnej, małej plastikowej przestrzeni. W tamtym czasie było to jedyne „leczenie” choroby, z którą się urodzili. Ten ciężki złożony niedobór odporności (SCID), jak oficjalnie nazywa się chorobę genetyczną, osłabia układ odpornościowy tak poważnie, że nawet najmniejsze infekcje dość szybko prowadzą do śmierci. Dlatego sterylna plastikowa bańka niczym druga skóra musi zapobiegać przedostawaniu się grzybów, wirusów czy bakterii do organizmu.
Po tym, jak Vetter był przetrzymywany od urodzenia w sterylnym środowisku przez 12 lat, możliwym wyjściem stała się technika przeszczepu szpiku kostnego. Jego młodsza siostra oddaje szpik kostny, a jeśli przeszczep się powiedzie, może z niego wyrosnąć nowy, pełnoprawny układ odpornościowy, dzięki czemu życie w sferze nie będzie już konieczne. Wszystko jednak okazuje się inaczej, o czym można przeczytać w opublikowanej w 2019 roku książce „Bursting the Bubble: The Tortured Life and Untimely Death of David Vetter”, której autorką jest psycholog Vetter Mary Murphy.
SCID to zbiór dziedzicznych, wrodzonych nieprawidłowości układu odpornościowego. Problem wynika z mutacji w genach, które odgrywają ważną rolę w produkcji i funkcjonowaniu komórek B i T. Bez tych komórek rozpoznawanie i usuwanie bakterii, wirusów i innych najeźdźców nie jest możliwe. To właśnie sprawia, że jest to choroba zagrażająca życiu. Najpowszechniejszą postacią jest SCID sprzężony z chromosomem X, ale niedobór ADA, zespół Omenna i mutacje w genie JAK3 i Artemis prowadzą do nieco innych postaci SCID. Nie wszystkie mutacje genetyczne prowadzące do SCID są jeszcze znane.
Dwa niezwykłe przypadki
To samo dotyczyło dziecka SCID skierowanego w 2005 r. do Radboud UMC w Holandii. Mimo że nie udało się znaleźć mutacji genetycznej, po trzech miesiącach dziecku przeszczepiono komórki macierzyste, co ostatecznie zakończyło się sukcesem pomimo wszystkich powikłań.
Wiele lat później grupa Alexandra Hoischena, specjalizująca się w wykrywaniu zaburzeń wrodzonej odporności, ponownie poszukiwała mutacji. Dokonali dwóch niezwykłych odkryć. Po pierwsze, zaobserwowali, że w wielu komórkach ciała pacjenta wystąpił nawracający mozaikowość. Co więcej, odkryli mutację genetyczną u pacjenta, która nie pochodziła od ojca ani matki. Powstała bardzo wcześnie u samego dziecka, tak zwana mutacja de novo.
Odwracanie mutacji
Hoischen wyjaśnia: „W każdym nowym pokoleniu dziesiątki zmian w DNA powstają spontanicznie, zwykle w częściach, które naszym zdaniem mają niewielki wpływ. Jednak jedna lub dwie z tych mutacji zachodzą w genach, co często ma poważne konsekwencje. U tego pacjenta zaobserwowaliśmy mutacja de novo w genie PSMB10.”
Co więcej, podczas rozwoju embrionalnego kilkakrotnie występowało zjawisko zwane mozaiką powrotną.
Hoischen mówi: „Występuje, gdy organizm próbuje usunąć paskudną mutację ze swoich własnych komórek, aby przywrócić stary stan. Można to nazwać rodzajem naturalnej terapii genowej. Dzieje się tak tylko w przypadku części komórek organizmu, odmiennych genetycznie powstają linie komórkowe: w skrócie mozaikowość. Rewertant, czyli odwrócenie mutacji. W którym fragmencie DNA zaobserwowaliśmy wystąpienie tej mozaikowatości? Dokładnie w miejscu, gdzie znaleźliśmy mutację de novo. To nas przekonało. patrząc we właściwym kierunku.”
Sześciu rzadkich pacjentów
Solidne dowody wymagają powtórzenia dla większej liczby podobnych pacjentów. Wraz z Casem van der Made i innymi współpracownikami Hoischen poszukiwał na całym świecie genetyków medycznych, którzy mieli pacjentów z podobną mutacją.
Dzięki swojej globalnej sieci wkrótce odnaleźli pacjenta w Izraelu, a następnie aż trzech pacjentów w ośrodku badawczym Sophie Hambleton w Newcastle, gdzie prowadzi się wiele badań genetycznych nad SCID. Zatem wszyscy z mutacją w danym genie. A wszystkie z tą samą specyficzną formą SCID: zespołem SCID-Omenna.
Podczas przygotowywania artykułu naukowego zawierającego ustalenia, w Newcastle podczas badań genetycznych noworodków odnaleziono szóstego pacjenta. Dzięki szybkiemu przeszczepowi komórek macierzystych dziecko przeżyło. Podobnie pacjent z Nijmegen. Wszyscy pozostali czterej pacjenci również otrzymali przeszczep komórek macierzystych, ale ostatecznie zmarli z powodu powikłań choroby.
Niszczarka molekularna
Pytanie brzmi, co dokładnie robi ten gen PSMB10 i dlaczego SCID-Omenn powstaje, gdy zachodzi w nim mutacja. Gen koduje białko, które zostaje wbudowane w proteasom – duży kompleks białkowy, który tnie uszkodzone, zbędne lub niebezpieczne białka niczym coś w rodzaju niszczarki molekularnej.
Hoischen wyjaśnia: „Wiemy już, że mutacje w innych białkach tego proteasomu prowadzą do chorób autozapalnych, takich jak okresowe gorączki. Możliwe, że mutacje w PSMB10 prowadzą do nieprawidłowego wycinania białek z bakterii i innych patogenów. To wycinanie jest ważne, ponieważ układ odpornościowy system rozpoznaje, wychwytuje i pozbywa się najeźdźców na podstawie dobrze wyciętych, charakterystycznych fragmentów białek, można powiedzieć, z dobrze wykonanych fotografii molekularnych.
„Bez dobrego obrazu nie można wykryć. Prawdopodobnie proteasom odgrywa również rolę w wycinaniu kawałków białka wykorzystywanych przez sam układ odpornościowy. Ale dokładny sposób, w jaki to robi, wymaga dalszych badań. Na razie ważne jest przekazywanie tej wiadomości pacjentom kluczowe było jak najszybsze.”
Drobnoziarniste badania przesiewowe noworodków
„To odkrycie ma bezpośrednie implikacje dla badań przesiewowych noworodków na SCID, doradztwa w zakresie przeszczepów komórek macierzystych i leczenia ciężkich powikłań zapalnych” – mówi Stefanie Henriet, pediatra zaangażowana w to badanie.
Od 2021 roku SCID z sukcesem uczestniczy w ogólnopolskim programie badań przesiewowych noworodków. W pewnym sensie projekcja przynosi więcej, niż oczekiwano. Podczas badania przesiewowego wykryto inne poważne schorzenia wykraczające poza ścisłą definicję SCID, takie jak poważny niedobór limfocytów T.
„Zaangażowani specjaliści zadają sobie pytanie, czy wykrywane inne choroby powinny również stać się formalną częścią badań przesiewowych nakłuć piętę” – napisała niedawno na swojej stronie internetowej Holenderska Rada ds. Zdrowia (Gezondheidsraad). „Można tego dokonać poprzez rozszerzenie obecnej definicji choroby docelowej. Sekretarz stanu ds. zdrowia, opieki społecznej i sportu zwrócił się do Rady Zdrowia o poradę w sprawie takiego rozszerzenia. W końcu rozszerzenie definicji choroby docelowej wiąże się z rozszerzeniem obecnej badania przesiewowe noworodków.”
Hoischen zauważa: „Badania genetyczne nad rzadkimi, ale poważnymi wrodzonymi zaburzeniami odporności, takie jak nasze wspólne badania nad tą specyficzną postacią zespołu SCID-Omenna [is] źródłem coraz bardziej szczegółowej diagnostyki i medycyny spersonalizowanej, która w coraz większym stopniu koncentruje się na indywidualnym pacjencie.
Więcej informacji:
Caspar I. van der Made i wsp., Rozszerzanie spektrum PRAAS: Mutacje de novo podjednostki immunoproteasomu typu 10 u sześciu niemowląt z zespołem SCID-Omenn, Amerykański dziennik genetyki człowieka (2024). DOI: 10.1016/j.ajhg.2024.02.013
Informacje o czasopiśmie:
Amerykański dziennik genetyki człowieka






