Naukowcy uczynili myszy potężniejszym narzędziem do badania szerokiego zakresu chorób ludzkich
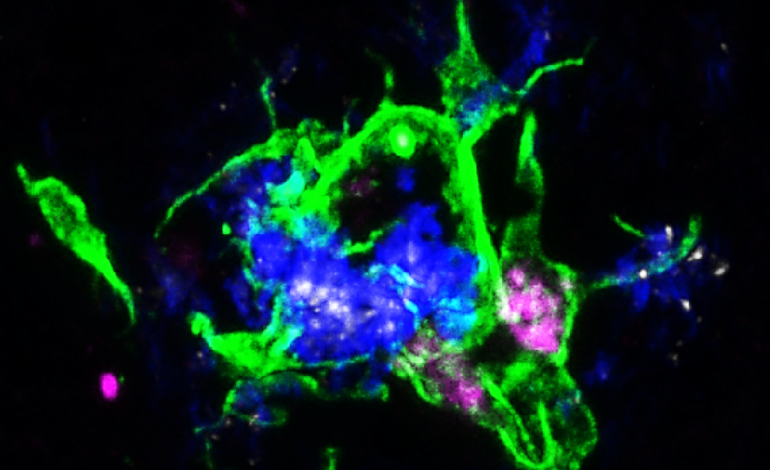
Nowy protokół nakłania mysie komórki macierzyste do rozwoju w wielu szczepach myszy, a nie tylko w szczepie 129. Umożliwia to naukowcom identyfikację, który szczep najlepiej przypomina komórki w różnych warunkach ludzkich. Źródło: Laboratorium Jacksona
× zamknąć
Nowy protokół nakłania mysie komórki macierzyste do rozwoju w wielu szczepach myszy, a nie tylko w szczepie 129. Umożliwia to naukowcom identyfikację, który szczep najlepiej przypomina komórki w różnych warunkach ludzkich. Źródło: Laboratorium Jacksona
U ludzi dokładnie ta sama mutacja w określonym genie może powodować bardzo różne wyniki. To trochę jak dodawanie tej samej ilości soli do różnych przepisów – efekt na gotowym daniu może być zupełnie inny, w zależności od mieszanki innych składników.
Teraz badacze z The Jackson Laboratory (JAX) opracowali potężną platformę do badania przyczyn tak różnych wyników mutacji. Praca, opublikowana dzisiaj w Postęp naukinie tylko zapewnia nowe możliwości odkrywania celów interwencji terapeutycznych, ale także stanowi znaczący krok naprzód w zaspokojeniu kluczowej potrzeby badania chorób ludzkich w kontekście różnorodności genetycznej.
Platforma opracowana przez profesora JAX Martina Perę, Ph.D. i współpracownik naukowy Daniel Cortes i ich współpracownicy wykorzystują komórki macierzyste ośmiu różnych szczepów myszy, aby naśladować różnorodność genetyczną obserwowaną u ludzi. Dzięki platformie udało im się zbadać wpływ czynników genetycznych na gen DYRK1A, od dawna kojarzony z autyzmem, małogłowiem i niepełnosprawnością intelektualną u ludzi.
Wynik: Chemiczne hamowanie funkcji DYRK1A lub wybijanie genu w komórkach macierzystych ośmiu szczepów myszy doprowadziło do wyraźnie odmiennych efektów we wzroście i naprawie neuronów, zapewniając molekularny wgląd w to, co może powodować oporność lub podatność na rozwój autyzm.
„Gdybyśmy badali jeden szczep, nie zaobserwowalibyśmy tak niesamowitego stopnia zmienności” – powiedziała Pera. „Ale badając osiem, pokazaliśmy, że modele komórek macierzystych na naczyniu mogą dokładnie przewidzieć wrażliwość i odporność danej osoby na mutacje powodujące chorobę, w tym przypadku zespół autystyczny. Dokładne porównanie wrażliwych i odpornych szczepów myszy na poziomie komórkowym również umożliwiło nam identyfikację potencjalnych celów interwencji terapeutycznej.”
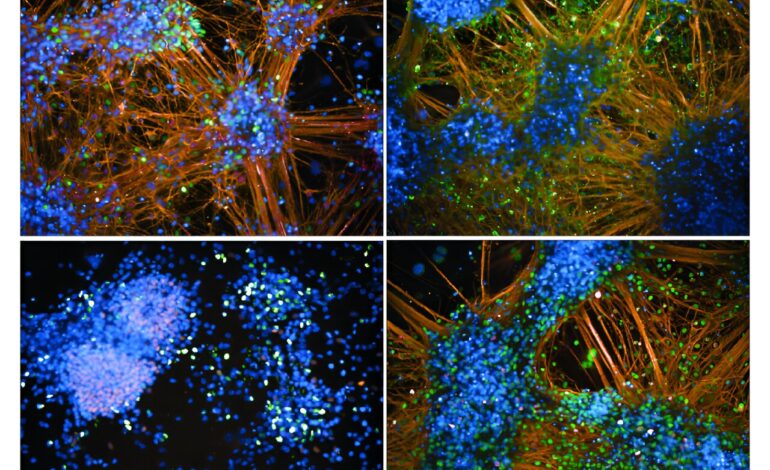
Aby stworzyć platformę, Pera, Cortes i współpracownicy, w tym profesorowie nadzwyczajni JAX, dr Laura Reinholdt i dr Kristen O’Connell, musieli pokonać kluczową przeszkodę. Odkryli, że przy użyciu powszechnie stosowanych protokołów można nakłonić jedynie komórki macierzyste szczepu myszy 129S1/SvlmJ (129) do różnicowania się w neurony. Zespół JAX — i to jest innowacja — opracował protokoły, które działały we wszystkich ośmiu szczepach i po modyfikacjach wytworzyły wiele typów neuronów z dużą wydajnością.
W poprzedniej pracy Pera badał także DYRK1A w indukowanych przez człowieka pluripotencjalnych komórkach macierzystych (iPSC), pochodzących z dorosłych komórek skóry lub krwi, które można pobudzić do przekształcenia się w komórki macierzyste. Te komórki macierzyste mogą następnie ponownie różnicować się w dowolne komórki w organizmie, po otrzymaniu określonych instrukcji genetycznych, co jest stanem znanym jako pluripotencja. Protokoły opracowane dla mysich linii komórkowych były skuteczne w generowaniu tego samego typu neuronów z wielu pluripotencjalnych linii ludzkich komórek macierzystych, co potwierdziło wyniki uzyskane na platformie komórek mysich.
Dalsze badania wykazały, że jeden szczep myszy, C57BL/6J (B6), najdokładniej modelował odpowiedź ludzkiego iPSC na niskie poziomy DYRK1A lub hamowanie podczas specyfikacji i ekspansji komórek nerwowych. Najmniej dotkniętymi szczepami były WSB/EiJ (WSB) i NZOHiLtJ (NZO). B6 i WSB również wykazały bardzo odmienne reakcje na uszkodzenie aksonów. Kompleksowe porównania między szczepami uwydatniły mechanizmy molekularne definiujące te różnice, wcześniej wiązane z zaburzeniami neurorozwojowymi.
Na koniec zespół Pery współpracował z doktorem Zhong-Wei Zhangiem w JAX, aby zbadać żywe myszy i sprawdzić, czy wrażliwość na B6 obserwowana w mysich komórkach macierzystych znajduje odzwierciedlenie w żywym systemie. A raczej nie żyć, gdyż odkryli, że nawet utrata jednej kopii DYRK1A skutkowała brakiem żywego potomstwa z tłem B6, podczas gdy nie miała wpływu na przeżycie w innych środowiskach, w tym 129.
Jednakże skrzyżowanie B6 ze 129 myszami dało żywe potomstwo z cechami klinicznymi związanymi z mutacjami DYRK1A u ludzi, co sugeruje skuteczny mysi model chorób takich jak choroba Alzheimera, zespół Downa, małogłowie, autyzm i niepełnosprawność intelektualna.
„Ta praca ilustruje siłę włączania różnorodności genetycznej do modeli chorób” – powiedział Pera. „Wykorzystanie komórek macierzystych in vitro umożliwia nam bezpośrednie porównanie myszy i ludzi oraz powiązanie wyników uzyskanych na szalce Petriego z wynikami uzyskanymi w całym organizmie. Podejście to będzie miało szerokie zastosowanie w genetyce chorób oraz usprawni i przyspieszy precyzyjne modelowanie chorób w Mysz.”
Więcej informacji:
Daniel Cortes i in., Platforma neurogenetyczna in vitro do precyzyjnego modelowania chorób u myszy, Postęp nauki (2024). DOI: 10.1126/sciadv.adj9305. www.science.org/doi/10.1126/sciadv.adj9305
Informacje o czasopiśmie:
Postęp nauki