Odkrycia genetyczne przeprowadzone na myszach rzucają światło na podatność na chorobę wirusową Ebola
10 maja 2024 r
Wirus wywołujący chorobę wirusową Ebola (EVD) był świadkiem rzadkich, ale powtarzających się ognisk, szczególnie w krajach afrykańskich. Choć większość ognisk ma charakter ograniczony, ryzyko śmierci w wyniku zarażenia wirusem Ebola wynosi średnio około 50%, co sprawia, że każde wystąpienie tej choroby stanowi pilny problem zdrowia publicznego.
Dane z innych epidemii, takich jak SARS i COVID-19, pomogły naukowcom zrozumieć rolę, jaką genetyka odgrywa w podatności na infekcje wirusowe. Naukowcy z UNC-Chapel Hill badali wpływ wirusa Ebola na specjalną rasę myszy, która ma podobieństwa z ludźmi pod względem wzorców reakcji wirusa i wyników zdrowotnych.
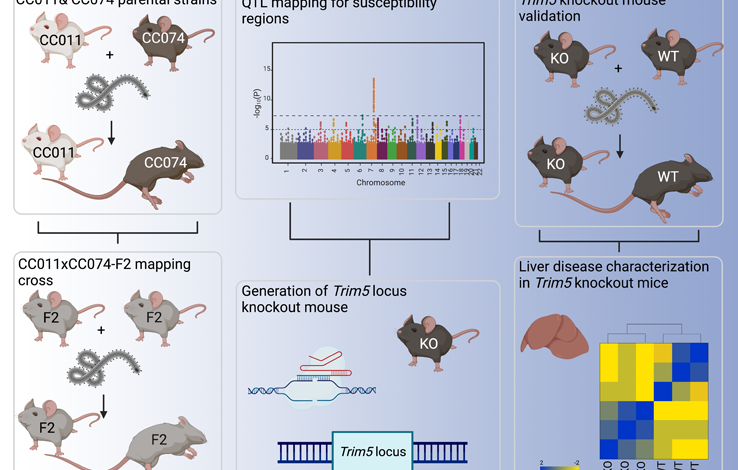
Streszczenie graficzne: Mapowanie loci podatności na patogenezę wirusa Ebola u myszy
We współpracy z naukowcami z Narodowego Instytutu Zdrowia (NIH) zespół ten opublikował nowe badanie Raporty komórkowe zidentyfikowanie dwóch konkretnych regionów genetycznych u tych myszy, które są podatne na najbardziej śmiercionośne skutki wirusa Ebola.
Te wady genetyczne, występujące w chromosomach ósmym i siódmym, są powiązane z dużą ilością wirusa we krwi i poważnym stanem zapalnym, szczególnie w wątrobie.
„Wiemy, że wątroba jest jednym z głównych narządów docelowych zakażenia wirusem Ebola” – powiedziała dr Alexandra Schaefer, adiunkt epidemiologii w UNC Gillings School of Global Public Health. Chociaż wirus jest przenoszony przez kontakt z zakażonymi płynami ustrojowymi, wątroba staje się dominującym miejscem replikacji wirusa i stanu zapalnego. U niektórych osób ta nadaktywna odpowiedź immunologiczna może często być śmiertelna. „W przypadku wirusa Ebola wszystko zaczyna się i kończy w wątrobie”.

Doktor Aleksandra Schaefer

Doktor Ralph Baric
Schaefer jest współautorem badania wraz z epidemiologami, wirusologami i genetykami z całej Karoliny i NIH w ramach trwających badań nad wirusem Ebola prowadzonych przez laboratorium dr. Ralpha S. Barica, Williama R. Kenana Jr., wybitnego profesora na Wydziale Epidemiologii w Gillings School oraz profesor w Zakładzie Mikrobiologii i Immunologii w UNC School of Medicine.
Baric zauważył, że „praca Alexa ujawniła zupełnie nowe zrozumienie tego, w jaki sposób wirus Ebola powoduje śmiertelne infekcje, zapewniając nowe możliwości diagnostyki, interwencji terapeutycznej i kontroli”.
Laboratorium od lat poszukuje potencjalnych strategii leczenia niebezpiecznych zagrożeń wirusowych poprzez mapowanie, w jaki sposób naturalna zmienność genów gospodarza reguluje ciężkość choroby u ssaków przy użyciu myszy krzyżowych współpracujących (CC). Te innowacyjne myszy zostały wyhodowane specjalnie tak, aby przypominały różnorodność genetyczną ludzi w nadziei na zmapowanie powszechnych genów ssaków, które wpływają na przebieg poważnych chorób wirusowych. Identyfikując te geny gospodarza, można opracować nowe strategie przeciwdziałania ciężkości choroby.
W nowym badaniu naukowcy odkryli podatność gospodarza na chromosom ósmy, który reguluje miano wirusa, czyli ilość wirusa we krwi. Większe miano wirusa zwykle wskazuje na postęp infekcji.
Zespół odkrył także drugą podatność gospodarza na chromosomie siódmym, gdzie obecność funkcjonalnego regionu genetycznego (locus) zwanego TRIM5 powiązano z ciężkim zapaleniem wątroby, utratą masy ciała i ostateczną śmiercią. W tym przypadku osoby z wadliwymi genami TRIM5 są chronione przed ciężką chorobą.
„TRIM to wrodzone geny odpornościowe” – wyjaśnił Schaefer. „Odgrywają ważną rolę w reakcji komórek na kontrolę infekcji i replikacji wirusa”.
Wiele TRIM aktywuje krytyczne funkcje organizmu, które zwalczają infekcje wirusowe. Jednakże naukowcy odkryli, że w przypadku zakażenia wirusem Ebola obecność funkcjonalnego locus TRIM5 w rzeczywistości prowadziła do gorszych wyników i ostatecznej śmierci, ponieważ wirus wywołał nadmierną odpowiedź immunologiczną zwaną burzą cytokin, powodując masową śmierć komórek, zapalenie i uszkodzenie wątroby. awaria.
Reakcje genetyczne zaobserwowane przez laboratorium u myszy CC zakażonych wirusem Ebola były podobne do odpowiedzi genetycznych zaobserwowanych wcześniej u myszy zakażonych wirusami wywołującymi SARS (SARS-CoV) i COVID-19 (SARS-CoV-2). Odkrycia te ostatecznie odegrały rolę w leczeniu obu chorób i opracowaniu szczepionek.
Chociaż obecnie dostępnych jest bardzo niewiele danych na temat biomarkerów identyfikujących ludzi, którzy mogą być podatni na śmiertelne infekcje wirusem Ebola, zespół badawczy ma nadzieję, że te nowe wyniki uzyskane na myszach będą równie cenne w poszukiwaniu skutecznych strategii leczenia i zapobiegania.
Schaefer twierdzi, że ponieważ znaczna część szkód wywołanych wirusem Ebola koncentruje się w wątrobie, ich kolejnym celem jest zbadanie dokładnego mechanizmu wykorzystywanego przez geny TRIM5 do powodowania niewydolności wątroby i śmiertelnych chorób.
„[TRIM5] to białko, które oddziałuje z innymi białkami w komórkach, aby skutecznie reagować na większość infekcji wirusowych. Wirus Ebola opracował strategię wykorzystania tej podstawowej strategii obrony gospodarza i obalenia jej. Zrozumienie mechanizmu wywołującego choroby” – powiedziała – „stworzy możliwości, aby coś z tym zrobić”.
Skontaktuj się z zespołem ds. komunikacji UNC Gillings School of Global Public Health pod adresem sphcomm@unc.edu.