Podatność genetyczna na neuropatię wzrokową u pacjentów z zaburzeniami związanymi z używaniem alkoholu | Journal of Medycyny Translacyjnej
Oświadczenie dotyczące etyki
Niniejsze badanie retrospektywne przeprowadzono zgodnie z zaleceniami etycznymi Deklaracji Helsińskiej. Uzyskała pozytywną opinię Komisji Etyki Szpitala Uniwersyteckiego w Angers we Francji pod sygnaturą 2020/149. Zebrano i retrospektywnie przeanalizowano dane dotyczące rutynowej opieki nad pacjentami po zatruciu alkoholem. Analizy genetyczne, wykonywane w ramach rutynowej diagnostyki etiologicznej neuropatii wzrokowej, wykonywano po uzyskaniu świadomej zgody pacjentów.
Uczestnicy badania
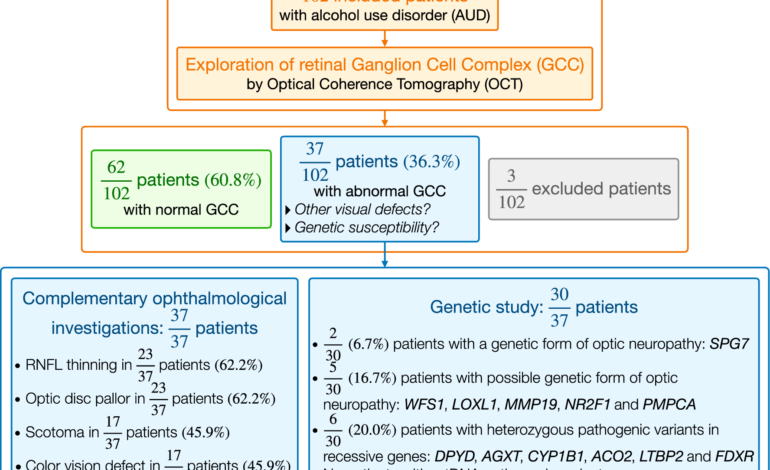
Zebraliśmy dane zdrowotne od 102 pacjentów zapisanych kolejno przez sześć miesięcy (od maja do listopada 2019 r.) na dedykowanym oddziale AUD na Oddziale Psychiatrii i Uzależnień Centrum Szpitala Uniwersyteckiego w Angers we Francji. U wszystkich włączonych do badania pacjentów (w wieku 21,5–62,3 lat) rozpoznano AUD zgodnie z kryteriami diagnostycznymi Diagnostic and Statistical Manual of Mental Disorders, wydanie 5 (DSM-5). Żaden z włączonych pacjentów nie zgłaszał objawów wzrokowych. Jednakże systematycznie oceniano strukturę ich nerwu wzrokowego za pomocą OCT w celu wykrycia utraty neuronów i aksonów siatkówki, co sugeruje niekliniczną neuropatię nerwu wzrokowego. Z badania wyłączono pacjentów z wcześniej rozpoznaną lub współistniejącą retinopatią lub neuropatią wzrokową.
W badaniach okulistycznych wykorzystano obrazowanie OCT skupione na tarczach optycznych (Topcon DRI Triton Swept-Source OCT), mające na celu pomiar grubości zarówno kompleksu komórek zwojowych (GCC), jak i okołobrodawkowej warstwy włókien siatkówki (RNFL). Ponieważ wiek prowadzi do zmniejszenia ilości GCC, urządzenie dokonało korekty za pomocą regresji liniowej. W zależności od wyników badania OCT, pacjentów włączonych do badania podzielono na dwie grupy: (1) grupa pacjentów z utratą neuronów siatkówki, definiowaną jako zmniejszenie średniego GCC w co najmniej jednym oku w porównaniu z danymi normatywnymi; oraz (2) grupę pacjentów bez utraty neuronów siatkówki, jeśli wyniki OCT w obu oczach mieściły się w granicach normy. Wszyscy pacjenci z grupy „neuropatia wzrokowa” zostali poddani pełnemu badaniu klinicznemu okulistycznemu, obejmującemu ocenę najlepiej skorygowanej ostrości wzroku, ciśnienia wewnątrzgałkowego i formalnego pola widzenia. Widzenie kolorów oceniano za pomocą testu widzenia kolorów z desaturą 15 Hue. Wszyscy pacjenci z utratą neuronów siatkówki zostali poddani szeroko zakrojonym badaniom mającym na celu wykluczenie innych przyczyn neuropatii wzrokowej (tj. uciskowej, zapalnej, zakaźnej, jaskrowej itp.). U włączonych pacjentów wykonano pomiary osoczowych poziomów witamin B9, B12, B1 i B6.
Analizy molekularne
Poszukiwania wariantów podatności genetycznej prowadzono na Zakładzie Biochemii i Biologii Molekularnej Centrum Szpitala Uniwersyteckiego w Angers we Francji. Analiza genetyczna obejmowała pełne sekwencjonowanie mitochondrialnego DNA i panel 87 genów jądrowych, rutynowo stosowanych w diagnostyce dziedzicznych neuropatii wzrokowych [17].
Genomowy DNA pacjentów ekstrahowano z krwi obwodowej przy użyciu zestawu do krwi DNA na aparacie EZ1 (Qiagen, Courtaboeuf, Francja). Obecność mutacji LHON i innych patogennych wariantów w mitochondrialnym DNA oceniano za pomocą pełnego sekwencjonowania mtDNA, jak opisano wcześniej [18]. Panel 87 genów jądrowych obejmował następujące znane i kandydujące geny zaangażowane w dziedziczne neuropatie nerwu wzrokowego: ACO2, ACOX1, AFG3L2, AGXT, ALG3, ANTXR1, AOX1, ASPA, ATAD3A, ATP1A3, ATXN1, ATXN7, AUH, BOLA3, BTD, C12orf65, C19orf12, CCDC88A, CISD2, CYP1B1, CYP7B1, DNAJC19, DNMT1, , DPYD, FA2H, FDXR, FH, FIS1, HSD17B10, IBA57, KLC2, LOXL1, LTBP2, MECR, MFF, MFN1, MFN2, MIEF1, MIEF2, MMP19, MTPAP, MYOC, NDUFS2, NEFH, NMNAT1, NR2F1, OMA1, OPA1, OPA3, OPN1SW, OPTN, PCLO, PDHX, PDSS1, PLAA, PLP1, PMPCA, POLR3A, PRPS1, RAB3GAP1, RPIA, RTN4IP1, SIX6, SLC19A2, SLC25A46, SLC52A2, SON, SPG7, SSBP1, TBCD, TBCE, TFG, TIMM50, TIMM8, TMEM126A, TRAPPC12, TSFM, TUBB4A, UCHL1, VPS33A, WARS2, WDR36, WDR73, WFS1, YME1L1,I ZNHIT3.
Panel przechwytywania został zaprojektowany w programie SureDesign firmy Agilent Technologies, uwzględniając granice eksonów i eksonów/intronów. Biblioteki skonstruowano przy użyciu docelowych sond wzbogacających DNA SureSelect zgodnie z zaleceniami producenta (Agilent Technologies France, les Ullis, Francja). Próbki gDNA fragmentowano przy użyciu biblioteki zestawu do fragmentacji enzymatycznej Agilent SureSelect. Po adapterach molekularnych i ligacji kodów kreskowych biblioteki amplifikowano i hybrydyzowano ze specyficznymi dla celu sondami panelu genów. Kompleksy sonda/DNA wychwytywano za pomocą kulek pokrytych streptawidyną i amplifikowano. Końcowe stężenia bibliotek określono przy użyciu zestawu Qubit dsDNA High Sensitivity Assay Kit (Thermo Fisher Scientific, Waltham, MA, USA). Dwanaście bibliotek połączono w równomolowym stężeniu (150 pM) i zsekwencjonowano w aparacie Ion Proton (technologia Ion Torrent, Thermo Fisher Scientific, Waltham, MA, USA).
Wywoływanie wariantów, adnotacje i ustalanie priorytetów wariantów genetycznych przeprowadzono przy użyciu naszego wewnętrznego rurociągu. Wywoływanie wariantowe opierało się na trzech wariantach wywołujących: deepvariant, strelka i gatkHC. Etapy adnotacji i ustalania priorytetów przeprowadzono przy użyciu reportera wariantu NCBI i ANNOVAR. Klasyfikację wariantów genów jądrowych określono za pomocą Varsome [19] i algorytmy Franklina [20] w oparciu o standardy i wytyczne American College of Medical Genetics and Genomics (ACMG) [21]. Zachowano warianty zgodne z obrazem klinicznym i sposobem dziedziczenia klas 5 (patogenna), 4 (prawdopodobnie patogenna) i 3 (VUS), które algorytmy silnie przewidywały jako patogenne. Udział patogennych wariantów mtDNA określono za pomocą bazy danych Mitomap [22].
Analizy statystyczne
Porównania pomiędzy dwiema grupami pacjentów (dotkniętymi i nie dotkniętymi chorobą) przeprowadzono przy użyciu testu sumy rang Wilcoxona z korekcją ciągłości w wersji R 4.3.0 (R Foundation for Statistical Computing, Wiedeń, Austria; w badaniu uwzględniono tylko pomiary prawego oka). analizę statystyczną OCT dostosowano do wieku, płci, używania narkotyków, palenia tytoniu i czasu trwania zatrucia alkoholem w analizie wieloczynnikowej przy użyciu systemu analizy statystycznej w wersji 9.4 (SAS Institute Inc., Cary, NC, USA). P-wartość (P) mniejszą niż 0,05 uznano za istotną statystycznie.
Dostępność danych
Zanonimizowane dane z tego badania można uzyskać u odpowiedniego autora na uzasadnioną prośbę.