Polimorfizmy genetyczne i parametry kliniczne związane z toksycznością nerkową u tajskich pacjentów z nowotworem układu krwiotwórczego otrzymujących metotreksat w dużych dawkach
Uczestnicy
Badanie to było jednoośrodkowym badaniem obserwacyjnym prowadzonym w szpitalu King Chulalongkorn Memorial Hospital (KCMH), Tajlandzkiego Czerwonego Krzyża w Bangkoku w Tajlandii. Badanie przeprowadzono zgodnie z Deklaracją Helsińską oraz Wytycznymi Dobrej Praktyki Klinicznej. Badanie zostało zatwierdzone przez Instytucjonalną Komisję Rewizyjną Wydziału Lekarskiego Uniwersytetu Chulalongkorn (IRB nr 429/64, COA nr 733/2021). Od wszystkich uczestników i/lub ich opiekunów prawnych uzyskano świadomą zgodę. Do obliczenia wielkości próby założyliśmy, że na podstawie najbardziej odpowiedniego badania, w którym stwierdzono związek toksyczności nerkowej i MTHFR Polimorfizmy C677T dotyczące toksyczności związanej ze stosowaniem metotreksatu w dużych dawkach u pacjentów z pierwotnym chłoniakiem rozlanym z dużych limfocytów B w OUN9. Badanie to wykazało, że toksyczność dla nerek wynosiła 17% w przypadku genotypu dzikiego i 32% genotypu heterozygotycznego/homozygotycznego wariantu. Całkowita wielkość próby wynosząca 278 (139 w każdym ramieniu) do porównania równości dwóch niezależnych proporcji z mocą 80% i poziomem istotności 0,0510. Pomimo obliczenia wielkości próby uwzględniono jedynie 80 uczestników ze względu na ograniczenia w zakresie zasobów i budżetu. Kryteriami włączenia byli pacjenci z Tajlandii z nowotworami hematologicznymi w wieku powyżej 18 lat, u których zdiagnozowano pierwotnego chłoniaka OUN, chłoniaka rozlanego z dużych komórek B, chłoniaka Burkitta, chłoniaka pozawęzłowego NK/T-komórkowego lub ALL/chłoniaka limfoblastycznego (LBL). Wszyscy uczestnicy otrzymywali w przeszłości schemat chemioterapii zawierający dożylnie HD-MTX (3–4 g/m2).2) z klirensem kreatyniny obliczonym za pomocą równania Cockcrofta-Gaulta > 60 ml/min11 przed rozpoczęciem HD-MTX od stycznia 2015 r. do lipca 2022 r. w szpitalu King Chulalongkorn Memorial Hospital. Pacjenci z wodobrzuszem lub wysiękiem opłucnowym zostali wykluczeni wraz z pacjentami w ciąży lub karmiącymi piersią. Wszyscy uczestnicy otrzymali standardowy protokół HD-MTX, który został zaadaptowany z poprzednich badań12,13,14. Protokół obejmował dożylną mieszaninę 1000 ml 5% wody z dekstrozą i 150 ml 7,5% NaHCO33 i 20 meq KCL podawano z szybkością 250 ml/h przez 8 godzin przed rozpoczęciem dożylnego podawania HD-MTX. Po rozpoczęciu dożylnego podawania HD-MTX, szybkość mieszaniny 5% wody z dekstrozą, 7,5% NaHCO3 i 20 meq KCL zmniejszono do 150 ml/h i kontynuowano przez 24 godziny. Dożylną leukoworynę podawano po 12 godzinach HD-MTX w dawce 25 mg co 6 godzin w 12 dawkach lub do momentu, gdy poziom MTX wynosił < 0,1 µM (mikromolowy). Poziom MTX monitorowano co 24 godziny po podaniu, aż poziom MTX wyniósł < 0,1 µM. Obowiązkowe jest odstawienie NLPZ, IPP, sulfametoksazolu i trimetoprimu, penicyliny i leków zawierających aspirynę w dniu dożylnego podania MTX i do 72 godzin po rozpoczęciu wlewu.
Genotypowanie
Od każdego uczestnika pobrano pełną krew (3 ml) do probówki zawierającej kwas etylenodiaminotetraoctowy (EDTA). Genomowy DNA ekstrahowano przy użyciu mini zestawu DNA (250) (QIAamp, Hilden, Niemcy) w Advance Hematology Laboratory, Division of Hematology, Department of Medicine, Chulalongkorn University, Bangkok, Tajlandia. Przeanalizowano czterdzieści dwa polimorfizmy 25 genów, w tym ARID5B (rs10994982)ADORA2A (rs5751876)ADORA3 (rs1544223, rs2298191 i rs3394), ADA (rs244076)ATYK (rs12995526, rs16853834, rs16853826, rs2372536, rs4673990, rs4673993 i rs7563206), BIRC5 (rs9904341)C1orf167 (rs1801131), DDRGK1 (rs2295553)DHFR (rs1643650 i rs7387), FPGS (rs1544105)GSK3B (rs3732361)GGH (rs11545078)HLA-E (rs1264457)IL12B (rs3212227)ITPA (rs1127354)KLRC1 (rs2734414, rs2734440 i rs7301582), MIR5189 (rs56292801),MROH2A (rs10929303)MTHFD1 (rs2236225), MTHFR (rs1476413 i rs1801133)MTR (rs1805087)MTRR (rs162040 i rs1801394), NR1I2 (rs3814055, rs6785049 i rs7643038), PTPRM (rs6506569), I TYM (rs2244500, rs2847153 i rs699517) przez MassARRAY® system (Agena Bioscience, USA) w Centrum Doskonałości Farmakokinetyki Klinicznej i Farmakogenomiki, Wydział Lekarski Uniwersytetu Chulalongkorn, Bangkok, Tajlandia. Geny te wybrano spośród tych, które odgrywają ważną rolę w szlaku MTX i stwierdzono, że ich warianty mają pewne znaczenie kliniczne2,5,6,7,9. Związek między szlakiem MTX a powiązaną farmakogenomią podsumowano na ryc. 1.
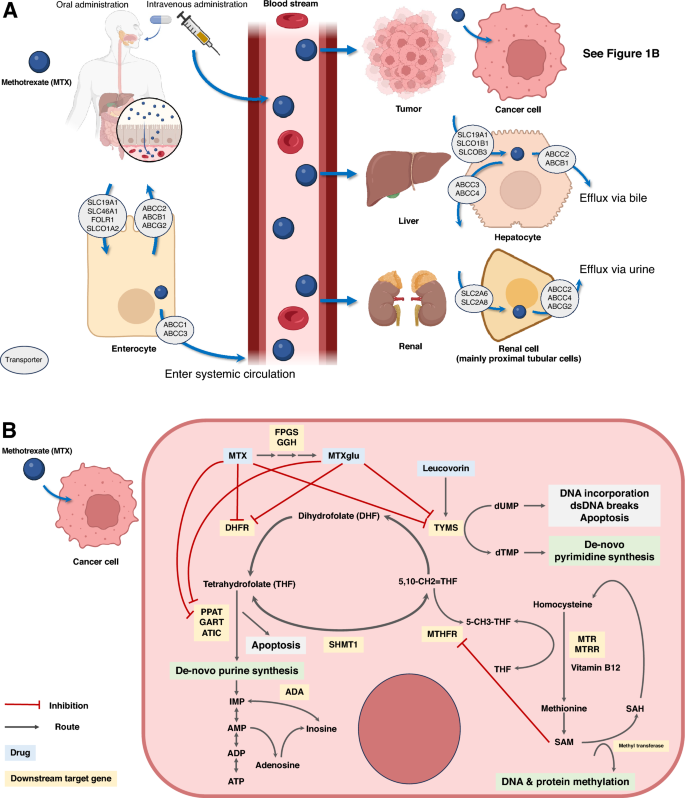
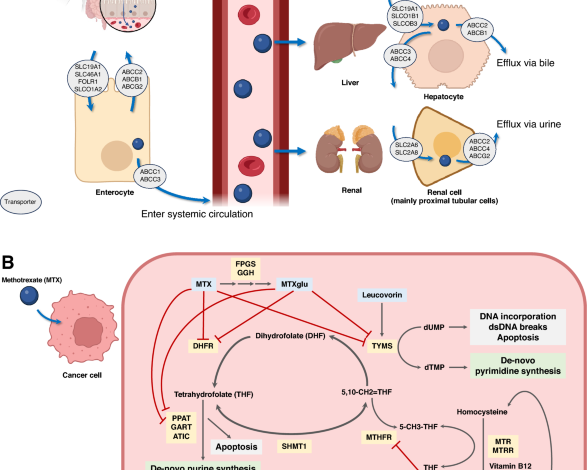
Szlak metotreksatu i powiązana farmakogenomika. (A) Rysunek ten ilustruje farmakokinetykę metotreksatu (MTX) z zastrzeżeniem różnic genetycznych w białkach transportujących błonę. Wchłanianie MTX w przewodzie pokarmowym odbywa się z udziałem SLC19A1 i SLC46A1, natomiast transportery ABC wpływają na biodostępność po podaniu doustnym. Podanie dożylne, powszechne w protokołach leczenia nowotworów hematologicznych, omija transportery żołądkowo-jelitowe, zapewniając podwyższoną biodostępność. Ponieważ nerki są głównymi narządami wydalniczymi MTX, na ryzyko uszkodzenia nerek wpływają różnice genomiczne i czynniki specyficzne dla pacjenta, co podkreśla znaczenie zrozumienia tych zawiłości farmakokinetyki MTX. (B) Rysunek ten podsumowuje złożoność szlaku MTX, syntezy puryn, syntezy pirymidyny, metabolizmu kwasu foliowego i powiązanych dalszych genów docelowych. Te różnice genomowe spowodowały zmianę poziomu MTX na poziomie komórkowym; w związku z tym może prowadzić do wyników klinicznych. MTX głównie hamuje DHFR, TYM, PPAT, GART, I ATYK prowadząc do apoptozy komórek, szczególnie w komórkach o dużej rotacji, takich jak komórki nowotworowe. Wariant MTRR Allel genu rs1801394, który w tym badaniu był istotnie powiązany z ostrym uszkodzeniem nerek, ma swoje główne działanie w zmianie z homocysteiny na metioninę. Według naszego zrozumienia wpływ tego wariantu na zmianę substratu komórkowego nie został dobrze poznany. Liczba ta została zmodyfikowana na podstawie badania farmakogenomiki przeprowadzonego przez PharmGKB®29,30i stworzony za pomocą BioRender.com. MTX metotreksat, DHF dihydrofolian, THF trihydrofolian, CHOCHLIK monofosforan inozyny, AMP monofosforan adenozyny, ADP difosforan adenozyny, ATP adenozynotrifosforan, wysypisko monofosforan dezoksyurydyny, dTMP monofosforan deoksytymidyny, SAM S-adenozylometionina, SAH Homocysteina S-adenozylowa.
Parametry kliniczne i laboratoryjne
Z elektronicznej dokumentacji medycznej zebrano retrospektywnie kompleksowe dane kliniczne, obejmujące wiek, płeć, powierzchnię ciała (BSA; kg/m2)2), choroby współistniejące, schemat chemioterapii, dawkę MTX, stężenie kreatyniny w surowicy na początku leczenia przed podaniem MTX, stężenie kreatyniny w surowicy po 24 i 48 godzinach po podaniu MTX oraz toksyczność MTX, w tym nieprawidłowe wyniki testów czynności wątroby i zapalenie błon śluzowych.
Zastosowano poziomy odcięcia dla toksyczności MTX zgodnie z Krajowym protokołem leczenia nowotworów u dzieci z 2016 r. i protokołem Tajskiej Grupy Onkologii Dziecięcej (THAIPOG) dla ALL/LBL14. Powyżej poziomów progowych MTX zdefiniowano na podstawie stężeń MTX w surowicy ≥ 150 µM po 24 godzinach od dawki i > 0,4 µM po 48 godzinach po dawce dla ALL/LBL14. W przypadku innych chorób poziomy powyżej progu MTX zdefiniowano na podstawie stężenia MTX w surowicy wynoszącego ≥ 5 µM po 24 godzinach od dawki i > 0,4 µM po 48 godzinach, co przyjęto na podstawie protokołu THAIPOG14. Toksyczność nerkową zdefiniowano jako wzrost stężenia kreatyniny w surowicy o > 25% w stosunku do wartości wyjściowych po 24 i 48 godzinach po podaniu dawki MTX w przypadku każdej choroby. Definicja toksycznego działania na nerki w tym badaniu została zdefiniowana zgodnie z protokołem THAIPOG14 który został zaadaptowany z Children’s Oncology Group (COG) AALL023215. Kryteria oceny zmian w leczeniu mających na celu zmniejszenie toksyczności MTX, w szczególności dożylne nawodnienie i podawanie leukoworyny w ramach naszego protokołu, zostały dostosowane w oparciu o toksyczność nerkową zgodnie z kryteriami zawartymi w protokołach THAIPOG i COG.
W przypadkach, gdy MTX podawano w wielu cyklach bez działania toksycznego na nerki, wykorzystano dane z pierwszego cyklu i uznano je za „grupę nie działającą toksycznie na nerki” w pierwotnej analizie wyników. W przypadku przypadków otrzymujących wielokrotne cykle, u których w którymkolwiek cyklu wystąpiło działanie toksyczne na nerki, wykorzystano dane z pierwszego cyklu zawierającego toksyczne działanie na nerki i przeanalizowano je jako „grupę działającą toksycznie na nerki”.
W przypadku drugorzędowego wyniku wyodrębniono dane z pierwszego, trzeciego i szóstego cyklu MTX. Analizowano powiązania pomiędzy stężeniem MTX po 24 godzinach od podania a stężeniem kreatyniny w surowicy. Badano także związek stężenia MTX z innymi parametrami klinicznymi. Toksyczne działanie na wątrobę zdefiniowano jako wzrost aktywności aminotransferazy asparaginianowej (AST) lub aminotransferazy alaninowej (ALT) > 3,0 razy powyżej górnej wartości prawidłowej; bilirubina całkowita lub bilirubina bezpośrednia > 3,0-krotność górnej wartości prawidłowej16. Zapalenie błony śluzowej sklasyfikowano przy użyciu wspólnych kryteriów terminologicznych dotyczących zdarzeń niepożądanych, wersja 5.016. Uznano, że wynik zapalenia błony śluzowej > 2 wskazuje na toksyczność MTX. Każdy cykl chemioterapii traktowano jako zdarzenie niezależne ze względu na konieczność eliminacji MTX z krążenia. Ponadto poziom kreatyniny musiał powrócić do normy lub wykazywać wstępny spadek przed wypisaniem pacjentów.
Analiza statystyczna
Analizę statystyczną przeprowadzono za pomocą programu IBM SPSS wersja 29.0. Dane opisowe podano w postaci częstotliwości i wartości procentowych. Dla danych o rozkładzie normalnym podano średnią i odchylenie standardowe (SD). W przypadku danych o rozkładzie normalnym zastosowano medianę i rozstępy międzykwartylowe (IQR). Do badania rozkładu normalnego zmiennych wykorzystano wizualizowane histogramy i testy Shapiro-Wilka. Zmienne kategoryczne analizowano za pomocą testu Chi-kwadrat, ilorazu szans (OR) z 95% przedziałem ufności (95% CI). W stosownych przypadkach zastosowano jednowymiarową regresję logistyczną i wieloczynnikową regresję logistyczną z uogólnionymi równaniami estymującymi (GEE) dla danych podłużnych. Predyktory istotności statystycznej z jednoczynnikowej regresji logistycznej przy P-wartości < 0,05, <0,01 i <0,001 wybrano do wieloczynnikowej regresji logistycznej za pomocą modeli GEE. Poziom istotny statystycznie wyniósł P<0,05.





