Techniki pojedynczych cząsteczek ujawniają nową dynamikę fałdowania białek związaną z postępem choroby Alzheimera
Nowy sposób badania fałdowania białek i powiązanych chaperonów, który chroni białka przed nienatywnymi interakcjami, może pomóc zrozumieć, co dokładnie wyzwala fałdowanie. Wiedza ta może pomóc śledzić postęp chorób takich jak rak, choroba Parkinsona i choroba Alzheimera.
Białka uczestniczą w niemal każdym procesie wewnątrz komórki. Muszą dostosować dobrze zdefiniowaną strukturę 3-D, aby wykonywać przypisaną im funkcję zwaną „natywną konformacją”. Jednak z powodu kilku warunków stresu chemicznego, środowiskowego lub fizycznego cząsteczki białka mogą zostać nieprawidłowo sfałdowane lub rozfałdowane, co prowadzi do dysfunkcji. Powoduje to agregację toksycznego materiału w komórce, co prowadzi do chorób. Choroby neurodegeneracyjne, takie jak choroba Alzheimera lub Parkinsona, zostały powiązane z tworzeniem toksycznych agregatów w komórce.
Podczas gdy kilka nowo przetłumaczonych białek może składać się spontanicznie, wiele z nich wymaga pomocy molekularnych chaperonów, aby osiągnąć swój natywny stan i uniknąć interakcji nienatywnych. Molekularne chaperony są niezbędne do utrzymania prawidłowego funkcjonowania cząsteczek białka. Oprócz pomocy w składaniu, mogą również naprawiać rozkładanie i nieprawidłowe składanie.
W świetle znaczenia chaperonów molekularnych dla naszego dobrego samopoczucia, naukowcy badają ich strukturę i funkcjonowanie w komórce. Masowe pomiary biochemiczne dostarczyły nam informacji na temat wydajności składania białek i zapobiegania agregacji, gdy chaperony są obecne podczas składania białek.
Jednakże konwencjonalne eksperymenty masowe nie mogą zbadać heterogeniczności cząsteczek chaperonowych i tego, jak każda z tych cząsteczek funkcjonuje w różnych komórkach. Ponadto krótkotrwałe stany przejściowe nie są przedmiotem badań eksperymentów masowych. Znaczenie tych stanów przejściowych w procesach metabolicznych pozostaje mało poznane.
W ostatnich latach rozwój technik badawczych na pojedynczych cząsteczkach otworzył nowe możliwości badania podstawowych właściwości biocząsteczek biorących udział w różnych reakcjach biochemicznych.
Zespół z Narodowego Centrum Nauk Podstawowych SN Bose (autonomicznego instytutu DST) pod kierownictwem prof. Shubhasisa Haldera wykorzystuje kowalencyjną pęsetę magnetyczną (CMT) stworzoną w ich laboratorium do badania właściwości fizycznych i chemicznych cząsteczek białek oraz wpływu chaperonów na sposób składania się i funkcjonowania tych cząsteczek.
To innowacyjne podejście dostarczyło bezprecedensowych spostrzeżeń na temat skomplikowanej dynamiki składania białek wspomaganego przez chaperony. Wśród kluczowych graczy w tym molekularnym balecie znajdują się białka szoku cieplnego Hsp70 i Hsp90, dwa z najlepiej zbadanych molekularnych chaperonów.
Spektroskopia sił pojedynczych cząsteczek ujawniła skomplikowaną dynamikę manipulacji białkiem wywołanym przez Hsp70. Skomplikowane szczegóły są kluczowe dla zrozumienia, w jaki sposób Hsp70 pomaga w fałdowaniu, stabilizacji i transporcie białka w różnych warunkach komórkowych.
Hsp90 jest również ważnym chaperonem, o którym wiadomo, że aktywuje i stabilizuje wiele białek, w tym receptory hormonów steroidowych i kinazy sygnałowe. Do scharakteryzowania wielu ścieżek i stanów kompleksu Hsp90 zastosowano techniki pojedynczych cząsteczek.
Dr Haldar i jego współpracownicy przewodzili tym badaniom, ujawniając wieloaspektowe możliwości pęset magnetycznych w manipulowaniu strukturami białek.
Ich odkrycia ujawniły nowe mechanizmy molekularnych chaperonów i dostarczyły wglądu w ich funkcjonowanie i implikacje dla homeostazy białek i chorób człowieka. Przegląd serii badań został opublikowany w czasopiśmie Trends in Biochem Sciences.
Podkreślają dynamikę mechaniczną leżącą u podstaw oddziaływań chaperonów z substratami pod wpływem siły oraz fakt, że chaperony, zwłaszcza te zlokalizowane w tunelach komórkowych, wykorzystują siłę powstającą podczas translokacji białka, aby ułatwić fałdowanie substratu.
Te chaperony związane z tunelem wykorzystują energię mechaniczną pochodzącą z tunelu do kierowania procesem składania, zapewniając w ten sposób właściwe dojrzewanie białek kluczowych dla istotnych funkcji komórkowych. Ponadto badanie ujawnia różnorodne funkcje mechaniczne wykazywane przez chaperony pod wpływem siły.
Naukowcy zaczynają teraz rozumieć dokładny mechanizm powstawania choroby Alzheimera z powodu sztywności mózgu. Gdy fizyczne podstawy chorób zwyrodnieniowych, takich jak choroba Alzheimera i Parkinsona, zostaną zrozumiane na poziomie molekularnym, można będzie zaprojektować leki ukierunkowane na mechaniczne role chaperonów. Ułatwi to zapobieganie postępowi tych chorób.
„Jednakże wiele kwestii pozostaje bez odpowiedzi, ponieważ działamy na styku badań podstawowych i translacyjnych” – mówi Debojyoti Chowdhury, współautorka artykułu przeglądowego.
Gdy tylko istniejące luki w zrozumieniu dynamiki chaperonów i ich białek klienckich zostaną zrozumiane, nauka farmaceutyczna będzie gotowa na kolejny skok naprzód. Techniki pojedynczych cząsteczek są kluczem do tej rewolucji.
Powiązane publikacje:
Ayush Chandrakant Mistry i in., Wyjaśnianie nowych mechanizmów chaperonów molekularnych za pomocą technologii pojedynczych cząsteczek, Trendy w naukach biochemicznych, 2023
Dodatkowe odniesienie
Lene Clausen i in., Chaperony molekularne w chorobach człowieka, Postępy w chemii białek i biologii strukturalnej, 2019
Chaudhuri i in., Bezpośrednia obserwacja mechanicznej roli opiekuńczych bakterii w fałdowaniu białekACS Biomakromolekuły, 2022

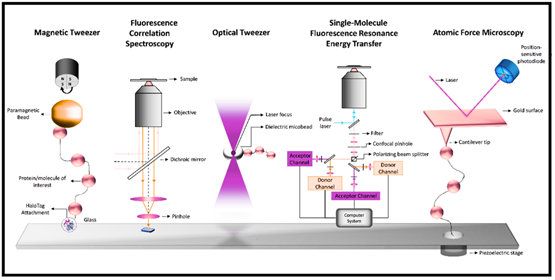
Rys. 1: Techniki pojedynczych cząsteczek: Pęseta magnetyczna, spektroskopia korelacji fluorescencji, Pęseta optyczna, rezonansowy transfer energii fluorescencji pojedynczych cząsteczek (FRET): mikroskopia sił atomowych.
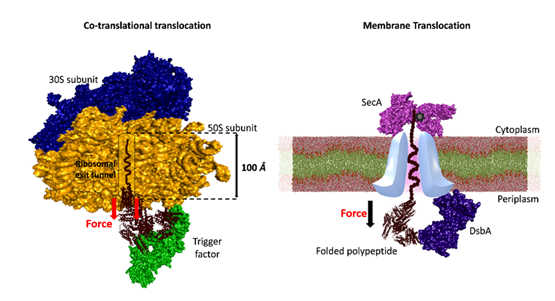
Rys. 2. Mechaniczne fałdowanie białek substratowych przez chaperony związane z tunelem (w tym przypadku czynnik wyzwalający i DsbA).