Zespół Dubina-Johnsona u bliźniąt powiązany z nowymi mutacjami genetycznymi
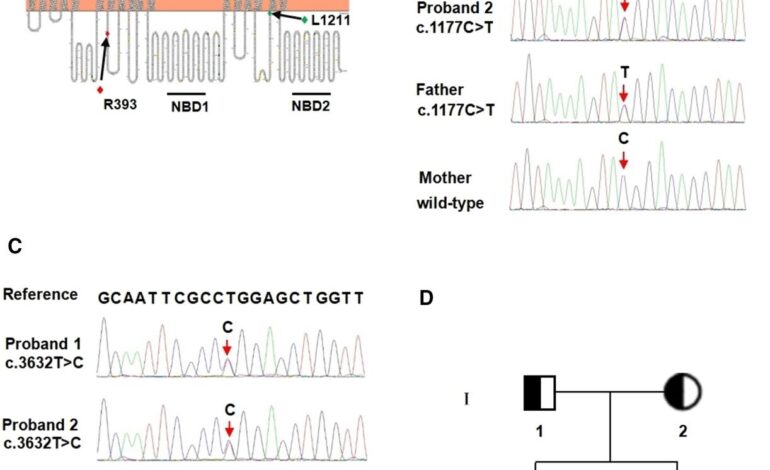
(A) Lokalizacja R393 i L1211 w przewidywanym modelu topologii białka MRP2. Pełnowymiarowy model wygenerowano za pomocą narzędzia Protter o otwartym kodzie źródłowym ((B) Analiza sekwencjonowania pliku ABCC2 gen wskazuje na związany z chorobą wariant probantów (II-2, II-3), mutacja zmiany sensu 1177C>T, która przewidywana jest jako powodująca mutację Arg393Trp (R393W) w sekwencji aminokwasowej białka MRP2 dziedziczonego od ojca (I -1) i (C) mutacja zmiany sensu 3632T>C (L1211P) odziedziczona od matki (I-2). (D) Rodowód przedstawiającej się rodziny ABCC2 warianty. Koła i kwadraty reprezentują odpowiednio kobiety i mężczyzn. Symbole wypełnione w połowie czarnym kolorem reprezentują heterozygotycznych nosicieli mutacji, a symbol znaku zapytania wskazuje normalnego osobnika bez badania genetycznego. Symbole wypełnione czarnym kolorem przedstawiają bliźniaczych probantów. MSD, domena rozciągająca się przez błonę; NBD, domena wiążąca nukleotydy. Źródło: Sun R, Chen Y, Zhu M i in.
× zamknąć
(A) Lokalizacja R393 i L1211 w przewidywanym modelu topologii białka MRP2. Pełnowymiarowy model wygenerowano za pomocą narzędzia Protter o otwartym kodzie źródłowym ((B) Analiza sekwencjonowania pliku ABCC2 gen wskazuje na związany z chorobą wariant probantów (II-2, II-3), mutacja zmiany sensu 1177C>T, która przewidywana jest jako powodująca mutację Arg393Trp (R393W) w sekwencji aminokwasowej białka MRP2 dziedziczonego od ojca (I -1) i (C) mutacja zmiany sensu 3632T>C (L1211P) odziedziczona od matki (I-2). (D) Rodowód przedstawiającej się rodziny ABCC2 warianty. Koła i kwadraty reprezentują odpowiednio kobiety i mężczyzn. Symbole wypełnione w połowie czarnym kolorem reprezentują heterozygotycznych nosicieli mutacji, a symbol znaku zapytania wskazuje normalnego osobnika bez badania genetycznego. Symbole wypełnione czarnym kolorem przedstawiają bliźniaczych probantów. MSD, domena rozciągająca się przez błonę; NBD, domena wiążąca nukleotydy. Źródło: Sun R, Chen Y, Zhu M i in.
Naukowcy z Chin i Włoch dokonali znaczącego przełomu w zrozumieniu zespołu Dubina-Johnsona (DJS), rzadkiej dziedzicznej choroby wątroby. Zespół zidentyfikował konkretne mutacje genetyczne odpowiedzialne za DJS u pary bliźniąt dwuzygotycznych, dostarczając cennych informacji na temat przyczyny choroby i potencjalnie poprawiając diagnozę pacjentów z niejasnymi objawami.
DJS zakłóca zdolność wątroby do usuwania produktów przemiany materii, co prowadzi do gromadzenia się bilirubiny, żółtego pigmentu we krwi. Może to powodować żółtaczkę – stan charakteryzujący się zażółceniem skóry i białek oczu. Jednak objawy DJS są często łagodne i łatwe do przeoczenia, co utrudnia rozpoznanie.
Badanie opublikowane w eGastroenterologia, wykorzystali sekwencjonowanie całego egzomu (WES), potężną technikę analizy genetycznej. Projekt WES umożliwił naukowcom zbadanie regionów kodujących białka wszystkich ludzkich genów w DNA bliźniąt. Ta szczegółowa analiza ujawniła dwie krytyczne mutacje w genie ABCC2, który dostarcza instrukcji dotyczących budowy białka zwanego MRP2. MRP2 pełni rolę transportera, eliminując produkty przemiany materii z komórek wątroby.
Wcześniej zgłaszano, że jedna ze zidentyfikowanych mutacji jest powiązana z DJS. Mutacja ta znacząco zmniejsza ogólną ilość białka MRP2 wytwarzanego przez komórki wątroby.
Zespół badawczy odkrył także nową mutację w genie ABCC2, niepowiązaną wcześniej z DJS. Ta nowo zidentyfikowana mutacja zmienia samo białko MRP2, utrudniając jego zdolność do prawidłowego funkcjonowania na błonie komórkowej.
Uważa się, że łączny efekt tych mutacji zakłóca normalny przepływ produktów przemiany materii z komórek wątroby. Uważa się, że to upośledzony system przetwarzania odpadów jest podstawową przyczyną DJS u tych bliźniaków.
ABCC2 c.1177C>T spowodowało podstawienie R393W w białku MRP2 w konserwatywnym regionie aminokwasowym u różnych gatunków. *Reprezentuje pozycję R393, oznaczoną czerwoną ramką. (B) Przewidywanie wartości aminokwasów. Strzałka i niebieska kropka wskazują położenie R393. (C) Lokalizacja R393 i L1211 w MRP2 według SWISS_MODEL. (D) W białku MRP2 typu dzikiego R393 tworzy wiązania wodorowe z G389, M397, Q429 i N1193. W zmutowanym białku MRP2 wiązanie wodorowe między W393 i Q429 oraz N1193 zostało zerwane i powstało nowe wiązanie wodorowe pomiędzy W393 i M424. (E) W białku MRP2 typu dzikiego L1211 tworzy wiązania wodorowe z L1207 i G1215. W zmutowanym białku MRP2 wiązanie wodorowe pomiędzy P1211 i L1207 zostało zerwane. Źródło: Sun R, Chen Y, Zhu M i in.
× zamknąć
ABCC2 c.1177C>T spowodowało podstawienie R393W w białku MRP2 w konserwatywnym regionie aminokwasowym u różnych gatunków. *Reprezentuje pozycję R393, oznaczoną czerwoną ramką. (B) Przewidywanie wartości aminokwasów. Strzałka i niebieska kropka wskazują położenie R393. (C) Lokalizacja R393 i L1211 w MRP2 według SWISS_MODEL. (D) W białku MRP2 typu dzikiego R393 tworzy wiązania wodorowe z G389, M397, Q429 i N1193. W zmutowanym białku MRP2 wiązanie wodorowe między W393 i Q429 oraz N1193 zostało zerwane i powstało nowe wiązanie wodorowe pomiędzy W393 i M424. (E) W białku MRP2 typu dzikiego L1211 tworzy wiązania wodorowe z L1207 i G1215. W zmutowanym białku MRP2 wiązanie wodorowe pomiędzy P1211 i L1207 zostało zerwane. Źródło: Sun R, Chen Y, Zhu M i in.
Badanie podkreśla skuteczność WES w diagnozowaniu DJS, szczególnie u pacjentów z nietypowymi objawami lub łagodnymi objawami. Tradycyjnie diagnozowanie DJS opierało się na objawach klinicznych, biopsjach wątroby i określonych badaniach. Jednak metody te nie zawsze mogą być rozstrzygające, zwłaszcza we wczesnych stadiach choroby.
WES oferuje bardziej precyzyjne i obiektywne podejście do diagnozowania DJS. Identyfikując konkretne mutacje genetyczne odpowiedzialne za tę chorobę, lekarze będą mogli pewnie diagnozować pacjentów i kierować ich przyszłym leczeniem.
Chociaż badanie to skupiało się na pojedynczym przypadku dotyczącym bliźniąt, jego ustalenia mają szersze implikacje. Naukowcy uważają, że mutacje te mogą występować u innych osób, u których zdiagnozowano DJS, co potencjalnie wyjaśnia pewną zmienność w obserwowanym nasileniu choroby. Aby potwierdzić te wstępne ustalenia, konieczne są dalsze badania z udziałem większej populacji pacjentów.
(A – C) Test okresu półtrwania MRP2WT i MRP2R393W przez zastosowanie cykloheksymidu (CHX) do blokowania syntezy białek i kontrolowania poziomu pozostałego białka metodą Western blot po 0, 2,5, 5 i 7,5 godzinie. Okres półtrwania MRP2WT wynosił około 5 godzin, podczas gdy MRP2R393W został prawie wyczerpany w ciągu 2,5 godziny. Wyniki analizy Western blot (D – F) i immunofluorescencji (G, H) MRP2WT i MRP2R393W ekspresja po leczeniu MG132 wskazywała, że blokada proteasomu MG132 akumulowała MRP2R393W ekspresję i osłabiły różnicę między MRP2 typu dzikiego i zmutowanego. (I, J) Podczas gdy chlorochina blokująca lizosomy (CHL) nie podniosła poziomu zmutowanego białka MRP2. Wszystkie dane wyrażono jako średnie ± gwiazdki SEM
reprezentują różnice istotne statystycznie (**p<0,01, ****p<0,0001, n=3 powtórzenia). ns, bez znaczenia. Źródło: Sun R, Chen Y, Zhu M i in. ×
zamknąć(A – C) Test okresu półtrwania MRP2 WTi MRP2 R393Wprzez zastosowanie cykloheksymidu (CHX) do blokowania syntezy białek i kontrolowania poziomu pozostałego białka metodą Western blot po 0, 2,5, 5 i 7,5 godzinie. Okres półtrwania MRP2 WTwynosił około 5 godzin, podczas gdy MRP2 R393Wzostał prawie wyczerpany w ciągu 2,5 godziny. Wyniki analizy Western blot (D – F) i immunofluorescencji (G, H) MRP2 WTi MRP2 R393Wekspresja po leczeniu MG132 wskazywała, że blokada proteasomu MG132 akumulowała MRP2 R393W
ekspresję i osłabiły różnicę między MRP2 typu dzikiego i zmutowanego. (I, J) Podczas gdy chlorochina blokująca lizosomy (CHL) nie podniosła poziomu zmutowanego białka MRP2. Wszystkie dane wyrażono jako średnie ± gwiazdki SEM
reprezentują różnice istotne statystycznie (**p<0,01, ****p<0,0001, n=3 powtórzenia). ns, bez znaczenia. Źródło: Sun R, Chen Y, Zhu M i in.
To badanie jest kluczowym krokiem naprzód w odkrywaniu tajemnic DJS. Wyjaśniając podłoże genetyczne choroby, torujemy drogę do lepszej diagnostyki, co potencjalnie może prowadzić do opracowania nowych strategii leczenia w przyszłości.
Zespół badawczy bada obecnie długoterminowe konsekwencje zdrowotne tych mutacji i ich potencjalny wpływ na czynność wątroby. Współpracują także z innymi badaczami, aby przeprowadzić większe badania w celu potwierdzenia swoich wyników i zbadania potencjalnych opcji terapeutycznych dla pacjentów z DJS. Więcej informacji: Rong-Yue Sun i wsp., wariant ABCC2p.R393W przyczynia się do zespołu Dubina-Johnsona poprzez ukierunkowanie MRP2 na degradację proteasomu,
eGastroenterologia
(2024). DOI: 10.1136/egastro-2023-100039Dostarczone przez Pierwszy Szpital Uniwersytetu Jilin






