Złagodzenie hamulców mikrogleju łagodzi patologię amyloidu u myszy
Czy zamiast dawać im więcej gazu, czy można zmusić mikroglej do usuwania płytek amyloidowych poprzez zwolnienie hamulców? Tak, twierdzą naukowcy pod kierunkiem Marco Colonny z Washington University w St. Louis. W czasopiśmie Science Translational Medicine z 3 kwietnia opisali hamujący receptor mikrogleju, LILRB4, którego ekspresja ulega zwiększeniu wokół płytek w chorobie Alzheimera i w mysich modelach amyloidozy. Przeciwciało przeciwko LILRB4 umożliwiło mikroglejowi ograniczenie akumulacji amyloidu u myszy. Jak? Uniemożliwiając ligandowi LILRB4, ApoE, wiązanie się z receptorem, przeciwciało hamowało aktywację LILRB4, pozostawiając mikroglej wolny do reagowania na płytki.
- Mikroglej wyrażający LILRB4 otacza płytki w tkance korowej AD.
- LILRB4 tłumi reakcję mikrogleju na płytki u myszy.
- Myszy, którym podano przeciwciało LILRB4, miały więcej fagocytarnego mikrogleju i mniej łysinek.
„To ważny artykuł, ponieważ aktywność mikrogleju musi być dokładnie kontrolowana, na przykład przez receptor hamujący punkt kontrolny układu odpornościowego LILRB4” – powiedział Alzforum Zhiqiang An z Centrum Nauki o Zdrowiu Uniwersytetu Teksasu w Houston.
Inni również chwalili badania. „LILRB4 to piękny cel specyficzny dla mikrogleju zaangażowanego w płytki, a przeciwciało to indukuje nowatorską odpowiedź immunomodulacyjną” – powiedział Oleg Butovsky z Brigham and Women’s Hospital w Bostonie. „To bardzo interesująca praca na temat mechanizmów mikrogleju w patogenezie AD, mająca wpływ na potencjalny rozwój leków” – powiedział Alzforum Yadong Huang z Uniwersytetu Kalifornijskiego w San Francisco.
Receptory leukocytów Ig-podobne (LILR) to grupa 11 markerów mikrogleju; pięć aktywuje komórki, pięć je hamuje. Wśród tych ostatnich są LILRB2 i LILRB4. LILRB2 wiąże toksyczne oligomery Aβ, prowadząc do utraty synaps (wiadomość z października 2018 r.; wiadomość z czerwca 2021 r.). LILRB4 wiąże się z ApoE i ulega silnej ekspresji w mikrogleju otaczającym płytki u myszy z amyloidozą, czyli mikrogleju związanym z chorobą (Deng i in., 2018; Yin i in., 2023; wiadomości z września 2023 r.). W badaniach asocjacyjnych obejmujących cały genom uznano locus zawierający zarówno LILRB2, jak i LILRB4 za czynnik ryzyka choroby Alzheimera (wiadomość z września 2021 r.; wiadomość z kwietnia 2022 r.).
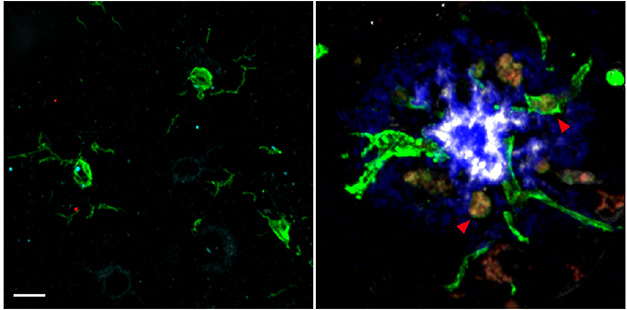
Aby zrozumieć, w jaki sposób LILRB2 i B4 ulegają ekspresji w mózgu AD, współautorzy, Jinchao Hou i Yun Chen, przeprowadzili analizę jednojądrowego RNA-Seq na mikrogleju z pośmiertnej tkanki korowej. W porównaniu z mikroglejem osób zdrowych, osoby z AD charakteryzowały się wysoką ekspresją LILRB4 i umiarkowanie podwyższoną ekspresją LILRB2. Immunohistochemia ujawniła więcej mikrogleju LILRB4-dodatniego w przypadkach AD, zwłaszcza wokół płytek amyloidowych (zdjęcie poniżej).

Kiełkowanie LILRB4. Podczas gdy rozgałęziony mikroglej (zielony) wisiał w korze zdrowej osoby dorosłej (po lewej), mikroglej wyrażający LILRB4 (czerwony) otaczał dodatnią pod względem ApoE (białą) płytkę amyloidową (niebieski) u osoby, która cierpiała na AD (po prawej). [Courtesy of Hou et al., Science Translational Medicine, 2024.]
Naukowcy podsumowali te zmiany u myszy, krzyżując zwierzęta 5xFAD ze zwierzętami posiadającymi fragment ludzkiego genu LILR o wielkości 200 kb, który kodował LILRB4 i kilka innych LILR. Hou i współpracownicy wykorzystali ten konstrukt do utrzymania elementów promotora i wzmacniacza napędzających LILRB4 w komórkach ludzkich. U 6-miesięcznego potomstwa mikroglej wyrażał więcej LILRB4 niż kontrole 5xFAD, a krzyżówki gromadziły więcej łysinek.
Co ciekawe, mniej mikrogleju dodatniego pod względem LILRB4 otaczało płytki amyloidowe u potomstwa, co sugeruje, że ludzki LILRB4 powodował słabą reakcję komórek na płytki. Dane wskazują, że mikroglej dodatni pod względem LILRB4 w pobliżu płytek w chorobie Alzheimera może słabo usuwać amyloid.
Czy zablokowanie receptora może poprawić klirens? Naukowcy stworzyli przeciwciało przeciwko LILRB4 o nazwie ZM3.1, a następnie co tydzień przez dwa miesiące wstrzykiwali je do brzuchów 4-miesięcznych myszy 5xFAD/LILRB4. U leczonych zwierząt 1,5 razy więcej mikrogleju dodatniego pod względem Iba1 otaczało płytki amyloidowe w korze niż u zwierząt kontrolnych, a mikroglej zwiększał ekspresję genów fagocytarnych i pochłaniał prawie dwukrotnie więcej włókienek Aβ. Leczone zwierzęta miały również o połowę mniej płytek w hipokampie, korze i ciele migdałowatym oraz mniej pobliskich neurytów dystroficznych (zdjęcie poniżej). Podsumowując, wyniki sugerują, że blokowanie LILRB4 włączyło mikroglej w tryb usuwania płytek.
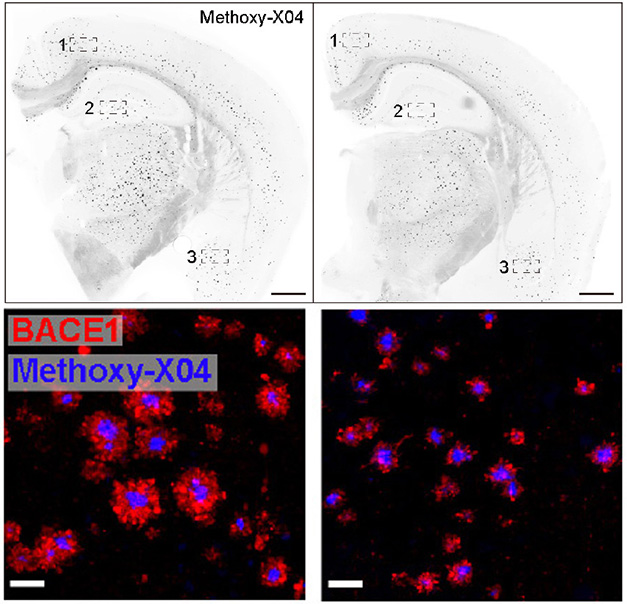
Zwalnianie hamulców. W porównaniu z myszą 5xFAD eksprymującą ludzki LILRB4 (po lewej), jedna, której podano przeciwciało LILRB4 (po prawej), miała o połowę mniej płytek amyloidowych (na górze) i o połowę mniej neurytów dystroficznych, jak zmierzono na podstawie poziomów BACE1 (czerwony, dół). [Courtesy of Hou et al., Science Translational Medicine, 2024.]
Wpływ immunoterapii na zachowanie był mniej wyraźny. Myszy, którym podano ZM3.1, spędzały mniej czasu w otwartych ramionach podwyższonego labiryntu plus, tj. miały mniej niepokoju niż zwierzęta nieleczone. Jednak znalezienie podwodnej platformy zajęło im tyle samo czasu, co nieleczonym myszom 5xFAD. Niemniej jednak Colonna postrzega to jako pozytywne. „Zmiany w zachowaniu odzwierciedlają zdolność przeciwciała do wpływania na funkcję” – powiedział Alzforum – „niezależnie od tego, jaka to jest funkcja”.
Jak ZM3.1 zmniejszył patologię? Doświadczenia z wiązaniem in vitro wykazały, że przeciwciało udaremnia wiązanie rekombinowanego LILRB4 z mysim ApoE, niezależnie od tego, czy jest ono przyłączone do włókienek Aβ, czy w postaci wolnej lipoproteiny. ZM3.1 zapobiegał także wiązaniu się LILRB4 z ludzkim ApoE3 lub E4. Eksperymenty z modelowaniem in silico i mutagenezą skupiły się na miejscu, w którym zarówno ApoE, jak i ZM3.1 wiążą LILRB4: pętlę pomiędzy dwiema zewnątrzkomórkowymi domenami Ig receptora.
Podsumowując, autorzy uważają, że ZM3.1 wiąże się z LILRB4 na mikrogleju, uniemożliwiając ApoE dostęp do receptora i jego aktywację. To utrzymuje metaforyczną stopę z dala od hamulca mikrogleju, umożliwiając komórkom reakcję na płytki (zdjęcie poniżej).
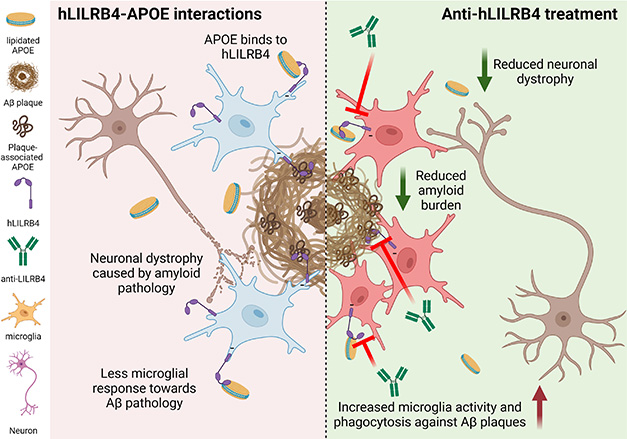
Blokowanie LILRB4 uwalnia mikroglej. W AD (po lewej) ApoE w lipoproteinach (żółte krążki) lub blaszkach (brązowe zawijasy) wiąże LILRB4 (fioletowy haczyk) na mikrogleju (niebieskie komórki). Dzięki temu komórki milczą, umożliwiając patologii amyloidu zniszczenie pobliskich neuronów (komórki brązowe). Leczenie (po prawej) przeciwciałem ZM3.1 (zielone Y) zapobiega wiązaniu się ApoE-LILRB4, umożliwiając mikroglejowi oswajanie płytek amyloidowych i ochronę neuronów. [Courtesy of Yun Chen, WashU.]
An widzi potencjał terapeutyczny ZM3.1. „Wydaje się możliwe opracowanie przeciwciał neutralizujących LILRB4 w celu aktywacji komórek mikrogleju w celu zmniejszenia gromadzenia się płytki nazębnej u pacjentów z AD” – powiedział. Butovsky zastanawiał się, jak immunoterapia może działać u nosicieli APOE4, ponieważ izoforma zapobiega ekspresji genów mikrogleju związanych z chorobą, takich jak LILRB4 (wiadomość z października 2023 r.).
Colonna współpracuje z firmą Ono Pharmaceutical z siedzibą w Osace w Japonii nad wprowadzeniem ZM3.1 do badań klinicznych nad chorobą Alzheimera, chociaż nie ma jeszcze harmonogramu. „Nadal musimy znaleźć najlepszy lek aktywujący mikroglej, dlatego ważne jest przetestowanie większej liczby przeciwciał i małych cząsteczek” – stwierdziła Colonna. – Chelsea Weidman Burke
Cytaty z wiadomości
-
Struktura krystaliczna Aβ i proponowany receptor rozwiązany
-
Opóźnienie fibrylizacji receptorów Aβ, zwiększenie toksyczności
-
Warianty PLCγ2 Przełącza kompaktory mikroglejowe
-
Z miliona próbek GWAS wyciska siedem nowych plam Alzheimera
-
Alert papierowy: opublikowano obszerną metaanalizę GWAS
-
W modelach amyloidowych i splątanych APOE4 paraliżuje mikroglej
Cytaty dotyczące modeli badawczych
-
5xFAD (C57BL6)
Cytaty papierowe
-
Deng M, Gui X, Kim J, Xie L, Chen W, Li Z, He L, Chen Y, Chen H, Luo W, Lu Z, Xie J, Churchill H, Xu Y, Zhou Z, Wu G, Yu C , John S, Hirayasu K, Nguyen N, Liu X, Huang F, Li L, Deng H, Tang H, Sadek AH, Zhang L, Huang T, Zou Y, Chen B, Zhu H, Arase H, Xia N, Jiang Y, Collins R, You MJ, Homsi J, Unni N, Lewis C, Chen GQ, Fu YX, Liao XC, An Z, Zheng J, Zhang N, Zhang CC.
Sygnalizacja LILRB4 w komórkach białaczkowych pośredniczy w supresji limfocytów T i nacieku nowotworu.
Natura. Paź 2018;562(7728):605-609. EPUB 2018, 17 października
PubMed. -
Yin Z, Rosenzweig N, Kleemann KL, Zhang X, Brandão W, Margeta MA, Schroeder C, Sivanathan KN, Silveira S, Gauthier C, Mallah D, Pitts KM, Durao A, Herron S, Shorey H, Cheng Y, Barry JL , Krishnan RK, Wakelin S, Rhee J, Yung A, Aronchik M, Wang C, Jain N, Bao X, Gerrits E, Brouwer N, Deik A, Tenen DG, Ikezu T, Santander NG, McKinsey GL, Baufeld C, Sheppard D, Krasemann S, Nowarski R, Eggen BJ, Clish C, Tanzi RE, Madore C, Arnold TD, Holtzman DM, Butovsky O.
APOE4 upośledza odpowiedź mikrogleju w chorobie Alzheimera poprzez indukcję punktów kontrolnych, w których pośredniczy TGFβ.
Nat Immunol. 2023 lis;24(11):1839-1853. EPUB 2023, 25 września
PubMed.






