Znaleziono nowy cel terapeutyczny w leczeniu ostrej białaczki szpikowej
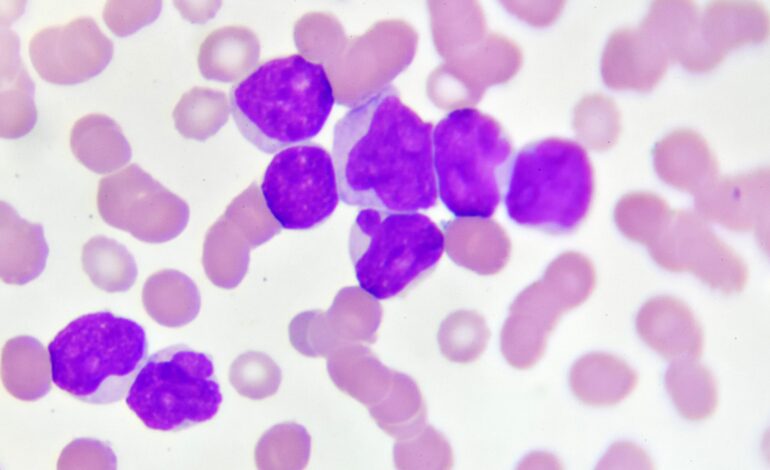
Francuscy i szwajcarscy naukowcy odkryli genetyczne i energetyczne właściwości komórek macierzystych białaczki, które są odpowiedzialne za ostrą białaczkę szpikową (AML) i sugerują, że zablokowanie specyficznego procesu wykorzystania żelaza przez te komórki otwiera drogę do nowych strategii terapeutycznych w walce z tą chorobą.
Potrzebne są pilnie nowe podejścia do leczenia AML — najczęstszego nowotworu krwi i szpiku kostnego u dorosłych. AML jest wysoce oporna na obecne metody leczenia. Połowa osób poniżej 60 roku życia, które chorują na tę chorobę, umiera z jej powodu, a śmiertelność wynosi 85% osób powyżej tego wieku. Naukowcy przypuszczają, że chorobę trudno leczyć z powodu uśpionych komórek macierzystych białaczki (LSC), które unikają chemioterapii. Komórki te, które pozostają nienaruszone po pierwszym leczeniu, mogą ponownie stać się aktywne, pobudzając ponowny rozwój AML.
Celowanie w te komórki macierzyste byłoby skuteczną metodą leczenia choroby, która mogłaby spowolnić lub zapobiec nawrotom, ale mechanizmy działania tych komórek nie są dobrze poznane. Ta nowa identyfikacja cech metabolicznych LSC przez zespół z Uniwersytetu Genewskiego (UNIGE), Szpitala Uniwersyteckiego w Genewie (HUG) i Inserm, opublikowana w czasopiśmie Medycyna translacyjna naukidostarcza nowych informacji na temat sposobu działania tych komórek i sugeruje sposoby ich zakłócenia.
Głównym badaczem w tym projekcie był Jérôme Tamburini, PhD, adiunkt w katedrze medycyny i Centrum Badań Translacyjnych w onkohematologii (CRTOH) na Wydziale Lekarskim UNIGE. Powiedział: „Korzystając z zaawansowanych technik bioinformatycznych i we współpracy z zespołem Petrosa Tsantoulisa, MD, PhD, z katedry onkologii i precyzyjnej onkologii w HUG, najpierw ustaliliśmy, że te uśpione komórki zawierają unikalny podpis genetyczny składający się z 35 genów. Kiedy użyliśmy tego podpisu w dużych bazach danych klinicznych pacjentów z AML, byliśmy w stanie wykazać, że ten podpis był silnie powiązany z prognozą choroby”.
Gdy zespół potwierdził ten związek z postępem choroby, starali się znaleźć różnice metaboliczne między uśpionymi i aktywnymi LSC. Zagłębiając się w reakcje chemiczne wewnątrz komórek, aby rozłożyć składniki odżywcze, aby zapewnić energię dla komórek i autofagię — proces, który pozwala komórkom na recykling składników komórkowych w celu zapewnienia energii w przypadku braku zewnętrznych składników odżywczych, dokonali ważnego odkrycia: uśpione LSC zależą od określonej formy lub autofagii zwanej ferrytynofagią, która ukierunkowuje główne cząsteczki magazynujące żelazo w komórkach, ferrytynę.
„Ten proces jest pośredniczony przez białko o nazwie NCOA4. Kontroluje ono dostępność żelaza w komórkach. Hamując je, genetycznie lub chemicznie, zaobserwowaliśmy, że komórki białaczkowe, zwłaszcza uśpione komórki macierzyste, są bardziej narażone na śmierć, podczas gdy zdrowe komórki macierzyste krwi pozostają nienaruszone” – wyjaśnił pierwszy autor, badacz Inserm, Clément Larrue, PhD, były badacz podoktorancki w laboratorium Tamburini, obecnie badacz w Toulouse Cancer Research Center.
Uzbrojony w tę wiedzę zespół zwrócił się następnie do mysich modeli AML i potwierdził, że blokowanie białka NCOA4, zmniejszyło wzrost komórek nowotworowych, zmniejszyło ich żywotność i utrudniło samoodnawianie LSC. Sugeruje to, że ukierunkowanie ferrytynofagii za pomocą tej ścieżki hamowania jest obiecującą strategią terapeutyczną w walce z AML. Związek, którego zespół używa do blokowania NCOA4, jest obecnie w fazie rozwoju przedklinicznego z zamiarem wykorzystania go w przyszłych badaniach klinicznych.






